题目内容
1.Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe所属基本反应类型是置换反应.在该反应中Al元素的化合价升高,该元素的原子失电子,被氧化;而Fe元素的化合价降低,该元素的原子得到电子,被还原.该反应中,Fe2O3发生了还原反应,Al发生了氧化反应,Fe2O3是氧化剂,Al是还原剂,Al2O3是氧化产物,Fe是还原产物.分析 Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe中,Fe元素的化合价降低,Al元素的化合价升高,结合氧化还原反应基本概念以及置换反应的定义来解答即可.
解答 解:此反应为一种单质与一种化合物生成另外一种单质与另一种化合物的反应,属于置换反应类型,反应中Al元素的化合价升高,该元素的原子失电子,被氧化,得到氧化产物;而Fe元素的化合价降低,该元素的原子得电子,被还原,生成还原产物,该反应中,Fe2O3发生了还原反应,Al发生了氧化反应,故答案为:置换反应、Al、失、氧化、Fe、得、还原、还原、氧化、Fe2O3、Al、Al2O3、Fe.
点评 本题主要考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和反应类型的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.由下列实验事实得出的结论正确的是( )
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | 将SO2通入Ba(NO3)2溶液,有白色沉淀生成 | BaSO3难溶于硝酸 |
| C | Na2SiO3溶液中通CO2气体出现浑浊 | 酸性:H2SiO3<H2CO3 |
| D | 浓硫酸使蔗糖变黑 | 浓硫酸有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
17.填写除去下列物质中的少量杂质(括号内为杂质),所用的试剂和操作方法
| 序号 | 待测物质 | 加入试剂 | 操作方法 |
| ① | 乙醛(乙酸) | NaOH溶液 | |
| ② | CH3CH2OH(水) | ||
| ③ | 苯(苯酚) | ||
| ④ | 乙酸乙酯(乙酸) |
14.设NA代表阿伏伽德罗常数,些列说法正确的是( )
| A. | 42g C3H6中含有的共用电子对数目为8NA | |
| B. | 2g CaCO3和8g KHCO3组成的混合物中碳原子数为0.1 NA | |
| C. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA | |
| D. | 1L 0.01mol•L-1 KAl(SO4)2溶液中含有的阳离子数目为0.02 NA |
6.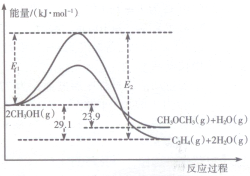 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+2H2O(g)
I.上述反应过程中能量变化如图所示:
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应i(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=-45.5kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
(3)比较平衡时容器1中c1(H2O)和容器2中c2(H2O)的大小:c1(H2O)<c2(H2O)(填“>”、“<”或“=”);三个容器中反应的化学平衡常数分别记为K1、K2和K3,三者的大小关系为K1=K2>K3.
(4)若容器l中平衡时CH3OH(g) 的转化率为80%,则该温度下反应i的平衡常数K=4.
 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+2H2O(g)
I.上述反应过程中能量变化如图所示:
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应i(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=-45.5kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
| 起始投料/mol 编号 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 恒温容器1 | 2 | 0 | 0 |
| 恒温容器2 | 0 | 2 | 2 |
| 绝热容器3 | 2 | 0 | 0 |
(4)若容器l中平衡时CH3OH(g) 的转化率为80%,则该温度下反应i的平衡常数K=4.
10.常温下,在下列指定条件的各溶液中,一定能大量共存的离子组是( )
| A. | 含0.1 mol.L-1SO2的溶液.中:Na+、Ba2+、Br-、Cl- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、Mg2+、N03-、SO42- | |
| C. | $\frac{C{(H}^{+})}{C({OH}^{-})}$=10-12的溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 不能使酚酞变红的无色溶液中:Na+、K+、ClO-、I- |
11.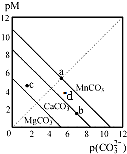 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pX=-lgc(X).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pX=-lgc(X).下列说法正确的是( )
 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pX=-lgc(X).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pX=-lgc(X).下列说法正确的是( )| A. | 在该温度下,MgCO3、MnCO3 的溶解度依次增大 | |
| B. | d点可表示MnCO3的过饱和溶液,且c(Mn2+)>c(CO32-) | |
| C. | b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) | |
| D. | c点可表示MgCO3 的不饱和溶液,且c(Mg2+)>c(CO32-) |
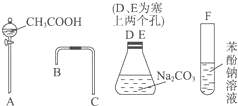 设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH.
设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH.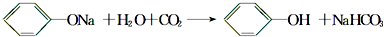 .
.