题目内容
18.用下列装置进行相应实验,能达到实验目的是( )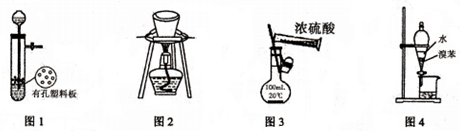
| A. | 图1所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 | |
| B. | 图2所示装置用于除去碳酸氢钠固体中的少量碳酸钠 | |
| C. | 图3所示装置配制100mL0.1mol•L-1的硫酸 | |
| D. | 图4所示装置用于分离出溴苯 |
分析 A.Cu和浓H2SO4在加热条件下反应;
B.碳酸氢钠不稳定,加热易分解;
C.不能在容量瓶中直接稀释溶液;
D.溴苯和水互不相溶.
解答 解:A.Cu和浓H2SO4在加热条件下反应,常温下不反应,故A错误;
B.碳酸氢钠不稳定,加热易分解,不能用加热的方法除杂,否则影响碳酸氢钠,故B错误;
C.容量瓶只能在常温下使用,且只能用来配制溶液,不能在容量瓶中直接稀释溶液,故C错误;
D.溴苯和水互不相溶,可用分液的方法分离,故D正确.
故选D.
点评 本题考查较为综合,涉及物质的制备、分离以及溶液的配制,为高考常见题型,侧重于学生的分析、实验能力的考查,注意把握实验的严密性和可行性的评价.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13. 工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
请回答下列问题:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
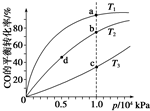
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是CD(填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
D.平均摩尔质量:M(a)>M(c),M(b)>M(d)
 工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | |||
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是CD(填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
D.平均摩尔质量:M(a)>M(c),M(b)>M(d)
14.设NA代表阿伏伽德罗常数,些列说法正确的是( )
| A. | 42g C3H6中含有的共用电子对数目为8NA | |
| B. | 2g CaCO3和8g KHCO3组成的混合物中碳原子数为0.1 NA | |
| C. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA | |
| D. | 1L 0.01mol•L-1 KAl(SO4)2溶液中含有的阳离子数目为0.02 NA |
6. 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+2H2O(g)
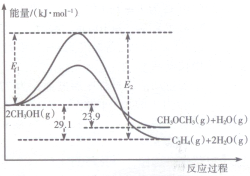
I.上述反应过程中能量变化如图所示:
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应i(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=-45.5kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
(3)比较平衡时容器1中c1(H2O)和容器2中c2(H2O)的大小:c1(H2O)<c2(H2O)(填“>”、“<”或“=”);三个容器中反应的化学平衡常数分别记为K1、K2和K3,三者的大小关系为K1=K2>K3.
(4)若容器l中平衡时CH3OH(g) 的转化率为80%,则该温度下反应i的平衡常数K=4.
 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+2H2O(g)
I.上述反应过程中能量变化如图所示:
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应i(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=-45.5kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
| 起始投料/mol 编号 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 恒温容器1 | 2 | 0 | 0 |
| 恒温容器2 | 0 | 2 | 2 |
| 绝热容器3 | 2 | 0 | 0 |
(4)若容器l中平衡时CH3OH(g) 的转化率为80%,则该温度下反应i的平衡常数K=4.
3.在3个2L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g)$?_{催化剂}^{高温、高压}$2NH3(g).按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:下列说法不正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol•L-1 | c1 | 1.5 | |
| NH3的体积分数 | φ1 | φ2 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol•L-1•min-1 | |
| B. | 在该温度下甲容器中反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}•(3{c}_{1}-1.5)}$ | |
| C. | 2c1<1.5 | |
| D. | 2ρ1=ρ2 |
10.常温下,在下列指定条件的各溶液中,一定能大量共存的离子组是( )
| A. | 含0.1 mol.L-1SO2的溶液.中:Na+、Ba2+、Br-、Cl- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、Mg2+、N03-、SO42- | |
| C. | $\frac{C{(H}^{+})}{C({OH}^{-})}$=10-12的溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 不能使酚酞变红的无色溶液中:Na+、K+、ClO-、I- |
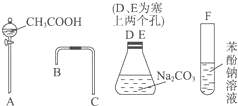 设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH.
设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH.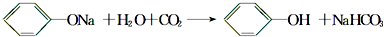 .
.
 .
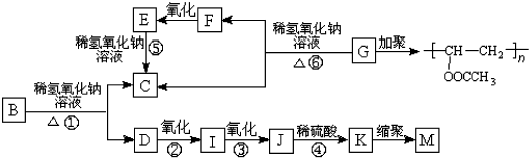
.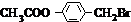 +3NaOH$→_{△}^{水}$CH3COONa+
+3NaOH$→_{△}^{水}$CH3COONa+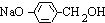 +NaBr+H2O,
+NaBr+H2O,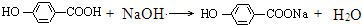 .
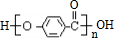
.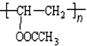 在氢氧化钠溶液中加热:
在氢氧化钠溶液中加热: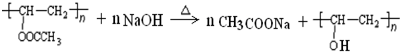 .
.