题目内容
4.Ⅰ.已知25℃时有关弱酸的电离平衡常数:| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
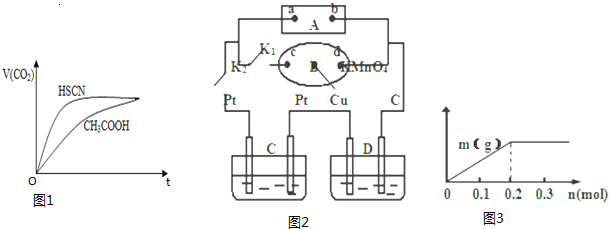
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是相同温度下HSCN比CH3COOH的电离平衡常数大,同浓度时电离出的氢离子浓度大,与NaHCO3溶液反应快
(2)若保温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号).
a.c(CH3COO-) b.c(H+) c.Kwd.醋酸电离平衡常数
Ⅱ.某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=11.在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va:Vb=10:1.
Ⅲ.如图2所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液均见图示.
(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源b端为负极,通电开始时,滤纸d端的电极反应式是2H++2e-=H2↑.
(2)已知C装置中溶液为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图3所示.则Cu2+、X3+、H+氧化能力由大到小的顺序是Cu2+>H+>X3+;D装置中溶液是H2SO4,则此装置电极C端的实验现象是在C端开始时有无色无味气体产生,一段时间后有红色物质析出.
分析 Ⅰ.(1)等浓度的酸的强弱不同,则c(H+)不同,c(H+)越大,反应速率越大;
(2)温度不变,水的离子积常数、醋酸的电离平衡常数不变,在醋酸溶液中加入一定量氨气,一水合氨电离出的氢氧根离子和氢离子反应生成水,促进醋酸电离;
Ⅱ.某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=11,据此计算离子积常数,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性说明氢离子和氢氧根离子物质的量相同,列式计算;
Ⅲ.(1)关闭K1,打开K2,为电解饱和食盐水装置,通电后,B的KMnO4紫红色液滴向c端移动,根据电解池工作原理可知阴离子向阳极移动判断电源的正负极并书写d端的电极反应式;
(2)打开K1,关闭K2,则为电解C、D两池,根据电解C的图象可知,开始即析出固体,总共0.2mol电子通过时,析出固体质量达最大,证明此时析出的固体是铜,此后,继续有电子通过,不再有固体析出,说明X3+不放电,H+放电,从而判断离子氧化性;D装置中溶液是H2SO4,电极C端与b负极相连即为阴极,开始氢离子得电子生成氢气,后阳极的铜失电子生成铜离子进入阴极在阴极析出,据此分析.
解答 解:Ⅰ.(1)等浓度的酸的强弱不同,则c(H+)不同,c(H+)越大,反应速率越大,因Ka(HSCN)>Ka(CH3COOH),溶液中c(H+):HSCN>CH3COOH,c(H+)大反应速率快,
故答案为:相同温度下HSCN比CH3COOH的电离平衡常数大,同浓度时电离出的氢离子浓度大,与NaHCO3溶液反应快;
(2)a、若保持温度不变,在醋酸溶液中加入一定量氨气,NH3+H2O?NH3.H2O?NH4++OH-,a.OH-+H+=H2O,所以促进醋酸电离,则c(CH3COO-)增大,故a错误;
b.OH-+H+=H2O,所以c(H+)减小,故b正确;
c.温度不变则Kw不变,故c错误;
d.温度不变,则醋酸电离平衡常数不变,故d错误;
故选b;
Ⅱ.某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=11,据此计算离子积常数Kw=0.01mol/L×10-11mol/L=10-13(mol/L),将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性说明氢离子和氢氧根离子物质的量相同,10-2×Va=$\frac{10{\;}^{-13}}{10{\;}^{-12}}$×Vb,得到Va:Vb=10:1,
故答案为:10:1;
Ⅲ.(1)据题意B的KMnO4紫红色液滴向c端移动,说明高锰酸根离子向c端移动,可推出极c端为阳极,则与之相连的电源a端为正极,b端为负极,所以通电滤纸d端为阴极,电极反应式为2H++2e-=H2↑,故答案为:负;2H++2e-=H2↑;
(2)根据电解C的图象可知,通电后就有固体生成,当通过电子为0.2mol时,析出固体质量达最大,证明此时析出的固体是铜.如果是X3+析出,电子数应该是0.3mol,则氧化能力为Cu2+>X3+,当电子超过0.2mol时,固体质量没变,说明这是阴极产生的是氢气,即电解水,说明氧化能力H+>X3+,故氧化能力为Cu2+>H+>X3+;
D装置中溶液是H2SO4,电极C端与b负极相连即为阴极,开始为氢离子得电子生成氢气,后阳极的铜失电子生成铜离子进入阴极在阴极析出,所以看到的现象为在C端开始时有无色无味气体产生,一段时间后有红色物质析出;故答案为:Cu2+>H+>X3+;在C端开始时有无色无味气体产生,一段时间后有红色物质析出.
点评 本题综合考查弱电解质电离,有关pH值的计算,电解原理以及根据图象获取信息、运用知识综合分析能力,明确弱电解质的电离常数与酸根离子水解程度之间的关系,KMnO4紫红色液滴向c端移动判断电源的正负极为解答该题的关键,注意电极方程式的判断,为易错点,题目难度中等.

| A. | 加入无水CuSO4,再过滤 | |
| B. | 加入生石灰,再蒸馏 | |
| C. | 加入浓H2SO4,再加热,蒸出乙醇 | |
| D. | 将96%的乙醇溶液直接加热蒸馏出来 |
| A. | 常温下浓硫酸与铝发生钝化,可在常温下用铝制容器贮运浓硫酸 | |
| B. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| C. | 高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是有强还原性,可消毒杀菌,氧化产物能吸附水中杂质 | |
| D. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 |
| A. | 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小 | |
| B. | 乙烯与溴发生加成反应的产物为溴乙烷 | |
| C. | 1 mol 苯恰好与3 mol氢气完全加成,说明一个苯分子中有三个碳碳双键 | |
| D. | n=7,主链上有5个碳原子烷烃共有五种 |
| A. | 浓盐酸、浓硫酸、浓硝酸均具有氧化性,都属于氧化性酸 | |
| B. | Na2O、SO2、BaSO4在熔融状态或溶于水时均能导电,都属于电解质 | |
| C. | NaOH、HNO3、NaNO3在水溶液中均能电离出离子,都属于离子化合物 | |
| D. | 金刚石、二氧化硅、碳化硅晶体中原子间均以共价键结合,都属于原子晶体 |
| A. | 酸式盐的水溶液一定显碱性 | |
| B. | 只要酸和碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性 | |
| C. | 纯水呈中性是因为水中氢离子的物质的量浓度和氢氧根离子的物质的量浓度相等 | |
| D. | 碳酸溶液中氢离子的物质的量浓度是碳酸根离子的物质的量浓度的2倍 |

| A. | 在NaCl晶体中,距Na+最近的Cl-形成正八面体 | |
| B. | 该气态团簇分子的分子式为EF或FE | |
| C. | 在CO2 晶体中,一个CO2 分子周围有12个CO2 分子紧邻 | |
| D. | 在碘晶体中,碘分子的排列有两种不同的方向 |
MnO4-+H2C2O4+H+--Mn2++CO2↑+H2O(未配平)
用4mL 0.001mol•L-1KMnO4溶液与2mL 0.01mol•L-1 H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:回答下列问题:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和X溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(2)如果研究浓度对化学反应速率的影响,应使用实验I和IV(用Ⅰ~Ⅳ表示,下同),实验Ⅳ中加入1mL蒸馏水的目的是确保I和IV组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变.
(3)如果研究温度对化学反应速率的影响,应使用实验I和III.
(4)研究发现,在反应开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.在排除温度的影响后,你猜想还可能是催化剂(或锰离子的催化作用)的影响.为了验证这种猜想,某同学在实验Ⅱ中加入X溶液进行验证,则X可能是B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.