题目内容
14.草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4-+H2C2O4+H+--Mn2++CO2↑+H2O(未配平)
用4mL 0.001mol•L-1KMnO4溶液与2mL 0.01mol•L-1 H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:回答下列问题:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和X溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(2)如果研究浓度对化学反应速率的影响,应使用实验I和IV(用Ⅰ~Ⅳ表示,下同),实验Ⅳ中加入1mL蒸馏水的目的是确保I和IV组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变.
(3)如果研究温度对化学反应速率的影响,应使用实验I和III.
(4)研究发现,在反应开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.在排除温度的影响后,你猜想还可能是催化剂(或锰离子的催化作用)的影响.为了验证这种猜想,某同学在实验Ⅱ中加入X溶液进行验证,则X可能是B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
分析 (1)反应中MnO4-为氧化剂,H2C2O4为还原剂,先写出方程式,再判断氧化剂和还原剂的物质的量之比;
(2)研究浓度对化学反应速率的影响,浓度变化,而其它条件必须相同;Ⅳ中只加入1mL10%硫酸,与I中加入的溶液体积不等,加入1mL蒸馏水时溶液的总体积相同;
(3)研究温度变化需要改变温度探究反应速率变化,其它条件不变;
(4)锰离子有催化作用;要想验证锰离子的催化作用,再加入硫酸锰即可.
解答 解:(1)在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,则氧化剂和还原剂的物质的量之比为2:5,
故答案为:2:5;
(2)研究浓度对化学反应速率的影响,浓度变化,而其它条件必须相同,则对比实验I和IV即可;对比实验I和IV,Ⅳ中只加入1mL10%硫酸,与I中加入的溶液体积不等,就不能保证,4mL 0.01mol•L-1KMnO4溶液与2mL 0.1mol•L-1 H2C2O4溶液,反应物浓度相同,实验IV中加入1mL蒸馏水的目的是保证了KMnO4溶液与H2C2O4溶液的起始浓度相同;
故答案为:I;IV;确保I和IV组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变;
(3)研究温度变化需要改变温度探究反应速率变化,而其它条件不变,则选择实验I和III,
故答案为:I;III;
(4)KMnO4与H2C2O4反应生成硫酸锰,锰离子有催化作用,所以猜想还可能是催化剂的作用;要想验证锰离子的催化作用,在做对比实验时同时加入硫酸锰观察反应速率是否变化即可,不能加氯化锰,因为氯化锰会引入氯离子,氯离子能被高锰酸钾氧化;
故答案为:催化剂(或锰离子的催化作用);B.
点评 本题考查了条件不同对反应速率影响的分析判断,主要是催化剂、温度、浓度对反应速率的影响探究,题目难度中等.

| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
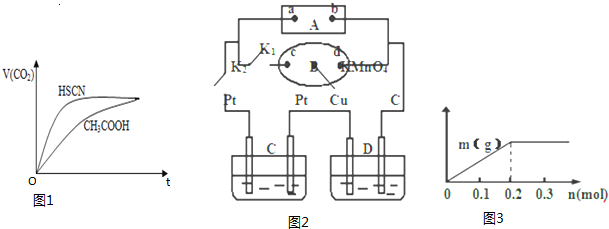
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是相同温度下HSCN比CH3COOH的电离平衡常数大,同浓度时电离出的氢离子浓度大,与NaHCO3溶液反应快
(2)若保温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号).
a.c(CH3COO-) b.c(H+) c.Kwd.醋酸电离平衡常数
Ⅱ.某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=11.在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va:Vb=10:1.
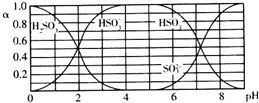
Ⅲ.如图2所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液均见图示.
(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源b端为负极,通电开始时,滤纸d端的电极反应式是2H++2e-=H2↑.
(2)已知C装置中溶液为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图3所示.则Cu2+、X3+、H+氧化能力由大到小的顺序是Cu2+>H+>X3+;D装置中溶液是H2SO4,则此装置电极C端的实验现象是在C端开始时有无色无味气体产生,一段时间后有红色物质析出.
| A. | 向浓度都为0.1mol•L-1Na2CO3和NaOH混合溶液中通入CO2,NaOH首先反应 | |
| B. | 向NH4Al(SO4)2溶液中滴加少量的NaOH溶液,NH4+首先反应 | |
| C. | 向浓度都为0.1mol•L-1的FeCl3和CuCl2混合溶液中加入铁粉,CuCl2首先反应 | |
| D. | 向0.1mol•L-1的FeCl3溶液中加入质量相同、颗粒大小相同的铁和铜,铜首先反应 |
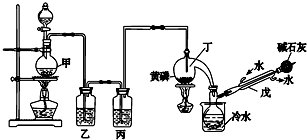
| A. | 溶液的pH=5时,硫元素的主要存在形式为HSO3- | |
| B. | 当溶液恰好呈中性时:c(Na+)>c(SO32-)+c(HSO3-) | |
| C. | 向pH=8的上述溶液中滴加少量澄清石灰水,$\frac{{c({HSO_3^-})}}{{c({SO_3^{2-}})}}$的值增大 | |
| D. | 向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)减小 |
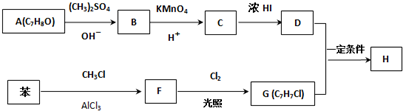
有关物质的部分性质如下:
| 熔点/℃ | 沸点/℃ | 其他 | |
| 黄磷 | 44.1 | 280.5 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3;2P+5Cl2(过量)$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
(1)仪器戊的名称为冷凝管.
(2)实验时甲中所发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)乙中盛放的试剂是饱和氯化钠溶液,其作用是除去氯气中的氯化氢;丙中盛放的试剂是浓硫酸,其作用是除去氯气中的水蒸气.
(4)向仪器丁中通入干燥、纯净的Cl2之前,应先通入一段时间的CO2,其目的主要是排净装置中的空气,防止空气中的水分和氧气与PCl3反应.
(5)碱石灰的作用是吸收多余的Cl2,防止污染环境;防止空气中的水蒸气进入影响产品纯度(答出一条即可).
(6)PCl3粗产品中常含有POCl3、PCl5等,加入黄磷(化学式用P表示)经加热除去PCl5的化学反应方程式为3PCl5+2P$\frac{\underline{\;\;△\;\;}}{\;}$5PCl3,后通过蒸馏(填实验操作名称),即可得到PCl3纯品.
| A. | 47 | B. | 57 | C. | 61 | D. | 175 |
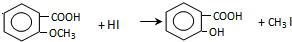 .
. .
. .
.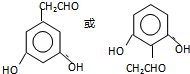 .
.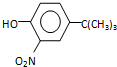
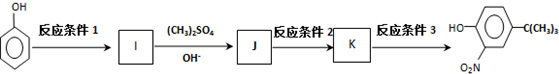
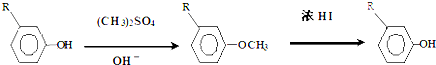
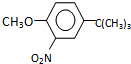 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.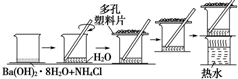 研究化学反应中的能量变化时,在一只小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据下图所示实验步骤进行操作.回答下列问题:
研究化学反应中的能量变化时,在一只小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据下图所示实验步骤进行操作.回答下列问题: 随着我国工业化水平的不断发展,研究空气污染、废水处理等问题成为重要课题.
随着我国工业化水平的不断发展,研究空气污染、废水处理等问题成为重要课题.