题目内容
15.欲用96%的乙醇溶液制取无水乙醇时,可选用的方法是( )| A. | 加入无水CuSO4,再过滤 | |
| B. | 加入生石灰,再蒸馏 | |
| C. | 加入浓H2SO4,再加热,蒸出乙醇 | |
| D. | 将96%的乙醇溶液直接加热蒸馏出来 |
分析 实验室制备无水酒精时,在96%酒精中加入生石灰(CaO)加热回流,使酒精中的水跟氧化钙反应,生成不挥发的氢氧化钙来除去水分,然后再蒸馏,这样可得99.5%的无水酒精,以此来解答.
解答 解:A.加入无水CuSO4,可检验水的存在,不能除杂,故A错误;
B.加入生石灰,生成不挥发的氢氧化钙来除去水分,再蒸馏可制取无水乙醇,故B正确;
C.浓硫酸具有脱水性,能使乙醇脱水,不能除杂,故C错误;
D.乙醇与水形成共沸混合物,不能直接蒸馏,故D错误.
故选B.
点评 本题考查物质分离提纯及除杂,为高频考点,侧重无水乙醇制备的考查,注意蒸馏原理的应用,选项D为易错点,题目难度不大.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
5.短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是( )
| A. | 原子半径A<B<C | B. | A的氢化物的稳定性大于C的氢化物 | ||
| C. | B的氧化物熔点比A的氧化物高 | D. | A与C可形成离子化合物 |
3. 如图是某学生设计的“硫燃烧现象及酸雨危害模拟实验”装置图.实验时操作步骤为:
如图是某学生设计的“硫燃烧现象及酸雨危害模拟实验”装置图.实验时操作步骤为:
①连接仪器,装好药品;
②将玻璃棒下端在酒精灯上烧红,迅速伸入广口瓶中点燃硫粉;③向锥形瓶中注入双氧水;
④硫粉完全燃烧后,用注射器向广口瓶中喷水.下列描述错误的是( )
 如图是某学生设计的“硫燃烧现象及酸雨危害模拟实验”装置图.实验时操作步骤为:
如图是某学生设计的“硫燃烧现象及酸雨危害模拟实验”装置图.实验时操作步骤为:①连接仪器,装好药品;
②将玻璃棒下端在酒精灯上烧红,迅速伸入广口瓶中点燃硫粉;③向锥形瓶中注入双氧水;
④硫粉完全燃烧后,用注射器向广口瓶中喷水.下列描述错误的是( )
| A. | 可以观察到,硫在氧气中燃烧发出蓝紫色火焰 | |
| B. | 实验结束时,应用注射器向装置中注入NaOH溶液以便更充分地吸收剩余的SO2气体 | |
| C. | A装置中的注射器的作用相当于分液漏斗,可以随时控制反应的发生和停止 | |
| D. | “酸雨”使绿叶变黄,使锌粒、镁片表面产生气泡 |
10.常用的下列量器刻度表示正确的是( )
①量筒的刻度由下向上增大,无零刻度
②在250mL容量瓶上,除刻度线外,还标有250mL和20℃
③滴定管的刻度是由上向下增大,零刻度在上
④温度计的刻度由下向上增大,零刻度偏下
⑤用托盘天平称量样品质量时,指针应在标尺的中央.
①量筒的刻度由下向上增大,无零刻度
②在250mL容量瓶上,除刻度线外,还标有250mL和20℃
③滴定管的刻度是由上向下增大,零刻度在上
④温度计的刻度由下向上增大,零刻度偏下
⑤用托盘天平称量样品质量时,指针应在标尺的中央.
| A. | ②③正确 | B. | ①②⑤正确 | C. | 都正确 | D. | ②③④⑤正确 |
4.Ⅰ.已知25℃时有关弱酸的电离平衡常数:
(1)25℃时,将20mL 0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20mL 0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示:
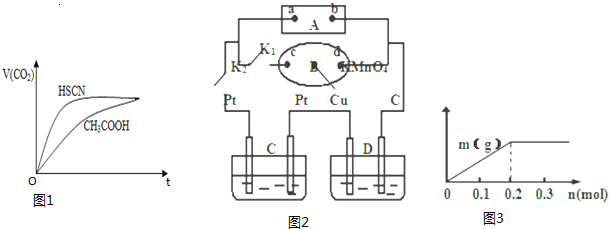
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是相同温度下HSCN比CH3COOH的电离平衡常数大,同浓度时电离出的氢离子浓度大,与NaHCO3溶液反应快
(2)若保温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号).
a.c(CH3COO-) b.c(H+) c.Kwd.醋酸电离平衡常数
Ⅱ.某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=11.在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va:Vb=10:1.
Ⅲ.如图2所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液均见图示.
(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源b端为负极,通电开始时,滤纸d端的电极反应式是2H++2e-=H2↑.
(2)已知C装置中溶液为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图3所示.则Cu2+、X3+、H+氧化能力由大到小的顺序是Cu2+>H+>X3+;D装置中溶液是H2SO4,则此装置电极C端的实验现象是在C端开始时有无色无味气体产生,一段时间后有红色物质析出.
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |

反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是相同温度下HSCN比CH3COOH的电离平衡常数大,同浓度时电离出的氢离子浓度大,与NaHCO3溶液反应快
(2)若保温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号).
a.c(CH3COO-) b.c(H+) c.Kwd.醋酸电离平衡常数
Ⅱ.某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=11.在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va:Vb=10:1.
Ⅲ.如图2所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液均见图示.
(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源b端为负极,通电开始时,滤纸d端的电极反应式是2H++2e-=H2↑.
(2)已知C装置中溶液为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图3所示.则Cu2+、X3+、H+氧化能力由大到小的顺序是Cu2+>H+>X3+;D装置中溶液是H2SO4,则此装置电极C端的实验现象是在C端开始时有无色无味气体产生,一段时间后有红色物质析出.
5.关于反应中的先后顺序,下列评价正确的是( )
| A. | 向浓度都为0.1mol•L-1Na2CO3和NaOH混合溶液中通入CO2,NaOH首先反应 | |
| B. | 向NH4Al(SO4)2溶液中滴加少量的NaOH溶液,NH4+首先反应 | |
| C. | 向浓度都为0.1mol•L-1的FeCl3和CuCl2混合溶液中加入铁粉,CuCl2首先反应 | |
| D. | 向0.1mol•L-1的FeCl3溶液中加入质量相同、颗粒大小相同的铁和铜,铜首先反应 |

 利用15N可以测定亚硝酸盐对地下水质的污染情况.
利用15N可以测定亚硝酸盐对地下水质的污染情况. ,15N2的结构式为15N≡15N;
,15N2的结构式为15N≡15N;