题目内容
7.硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4•SO3)、硫代硫酸(H2S2O3)等等,在工业上有广泛的应用.它们对应的钠盐同样也是重要的化工产品.(一).硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革的还原剂,它受热、遇酸易分解.工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程.

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)$\frac{\underline{\;△\;}}{\;}$Na2S2O3(aq) (Ⅲ)
(1)烧瓶A中发生反应的离子方程式为:SO32-+H2SO4=SO42-+SO2↑+H2O.装置D的作用是防止倒吸.
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择c.
a.蒸馏水 b.饱和Na2SO3溶液c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有ad.
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(4)为了保证硫代硫酸钠的产量,实验中通入SO2不能过量,原因是若二氧化硫过量会使溶液呈酸性,使硫代硫酸钠发生分解.
(二)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.Na2S2O5溶于水即生成NaHSO3.
(5)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是ae(填序号).
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸d.加入品红溶液 e.用蓝色石蕊试纸检测
(6)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
葡萄酒样品100.00mL$→_{蒸馏}^{盐酸}$馏分
 溶液出现蓝色且30s内不褪色
溶液出现蓝色且30s内不褪色方程式为SO2+I2+2H2O=H2SO4+2HI)按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为0.16g•L-1. 上述实验过程中,若有部分HI被空气氧化,则测得结果偏低(填“偏高”“偏低”或“不变”).其原因是4HI+O2=2I2+2H2O(用化学方程式表示)
分析 (一)(1)烧瓶A中亚硫酸钠与硫酸反应生成二氧化硫、硫酸钠和水;D可防止液体倒吸;
(2)观察SO2的生成速率,则溶液不能与SO2反应;
(3)烧杯、锥形瓶需要加热时必须使用石棉网,蒸发皿、试管可直接加热;
(4)由题目信息可知,硫代硫酸钠(Na2S2O3)遇酸易分解,而二氧化硫过量会使溶液呈酸性;
(二)(5)NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,故检验溶液呈酸性即可;
(6)由消耗碘的量,结合SO2+I2+2H2O═H2SO4+2HI计算二氧化硫的质量,进而计算浓度;若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小.
解答 解:(1)烧瓶A中亚硫酸钠与硫酸反应生成二氧化硫、硫酸钠和水,其反应的离子方程式为:SO32-+H2SO4=SO42-+SO2↑+H2O;D中左侧为短导管可防止液体倒吸;
故答案为:SO32-+H2SO4=SO42-+SO2↑+H2O;防止倒吸;
(2)观察SO2的生成速率,是通过观察溶液中产生气泡的快慢来判断,所以溶液不能与SO2反应,选项中只有饱和NaHSO3溶液与二氧化硫不反应,
故答案为:c;
(3)体积较大的玻璃仪器在加热时,仪器下面要放石棉网,防止仪器受热不均而炸裂,其中烧杯、锥形瓶加热时必须使用石棉网,
故答案为:ad;
(4)由题目信息可知,硫代硫酸钠(Na2S2O3)遇酸易分解,若二氧化硫过量会使溶液呈酸性,故实验中通入的SO2不能过量,防止硫代硫酸钠分解,
故答案为:若二氧化硫过量会使溶液呈酸性,使硫代硫酸钠发生分解;
(二)(5)NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,测定溶液的pH,可以确定溶液酸碱性,酸性溶液可以使湿润蓝色石蕊试纸变红,所以能用测定溶液pH值、湿润的蓝色石蕊试液检验,而加入Ba(OH)2溶液、HCl溶液、品红溶液都不能说明溶液呈酸性,故选ae;
故答案为:ae;
(6)令100mL葡萄酒中二氧化硫的质量为mg,则:
SO2+2H2O+I2═H2SO4+2HI
64g 1mol
mg 0.025L×0.01mol/L
所以$\frac{64g}{mg}$=$\frac{1mol}{0.025L×0.01mol/L}$,
解得m=0.016,
故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为$\frac{0.016g}{0.1L}$=0.16 g/L;
若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低;HI与氧气反应的化学方程式为:4HI+O2=2I2+2H2O;
故答案为:0.16;偏低;4HI+O2=2I2+2H2O.
点评 本题考查物质的制备实验、实验方案设计、物质含量的测定、氧化还原反应滴定等,难度中等,明确实验原理是解本题关键,根据物质的性质分析解答,注意元素化合物知识的积累和灵活运用.

①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=-99kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=+41kJ.mol-1
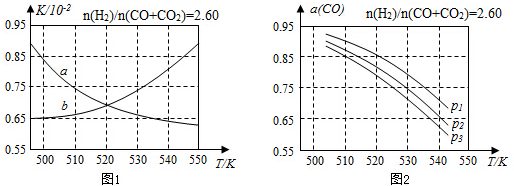
(2)反应①的化学平衡常数K的表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母),其判断理由是反应①正反应为放热反应,平衡常数随温度升高而减小.
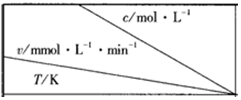
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示.a(CO)值随温度升高而减小(填“增大”或“减小”),其原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小.图2中的压强由大到小为P1>P2>P3,其判断理由是相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高
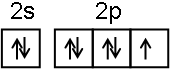
 | 0.600 | 0.500 | 0.400 | 0.300 |
| 318.2 | 3.60 | 3.00 | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | a=6.00 | |
| B. | 同时改变反应温度和蔗糖的浓度,v可能不变 | |
| C. | b<318.2 | |
| D. | 不同温度时,蔗糖浓度减少一半所需的时间相同 |
| A. | c(OH-)=c(Na+)+c(H+) | |
| B. | 该溶液中的c(OH-)=1.0×10-3mol•L-1 | |
| C. | 加水稀释104倍所得溶液显碱性 | |
| D. | 与pH=3的HF溶液等体积混合所得溶液:c(Na+)=c(F-)+c(HF) |
| A. | Cl2通入Na2CO3溶液中 | B. | CO2通入CaCl2溶液中 | ||
| C. | NH3通入AgNO3溶液中 | D. | SO2通入NaHS溶液中 |
| A. | NH4+、Al3+、NO3-、AlO2- | B. | Na+、Fe3+、HSO3-、OH- | ||
| C. | Cu2+、NH4+、SO42-、Cl- | D. | K+、H+、I-、ClO- |
 利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得.
利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得.
 ;NF3中心原子轨道的杂化类型为sp3.
;NF3中心原子轨道的杂化类型为sp3.
 ,G的结构简式为
,G的结构简式为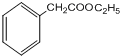 .
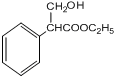
.

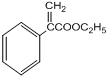 +H2O.
+H2O.