题目内容
16.[有机化学基础]颠茄酸酯(J)是一种用于胃肠道平滑肌痉挛及溃疡病的辅助治疗药物,其合成路线如图: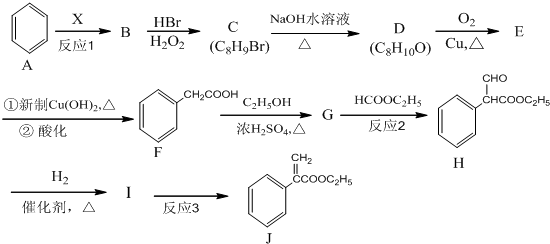
回答下列问题:
(1)烃B中含氢的质量分数为7.69%,其相对分子质量小于118,且反应1为加成反应,则B的分子式为C8H8,X的化学名称为乙炔.
(2)C→D的反应类型为水解(或取代)反应,G→H 的反应类型为取代反应.
(3)D的结构简式为
 ,G的结构简式为
,G的结构简式为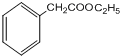 .
.(4)反应3的化学方程式为
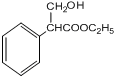

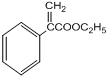 +H2O.
+H2O.(5)J的核磁共振氢谱有6个峰.
(6)化合物I有多种同分异构体,同时满足下列条件的结构有6种.
①能发生水解反应和银镜反应
②能与FeCl3溶液发生显色反应
③苯环上有四个取代基,且苯环上一卤代物只有一种.
分析 烃B中含氢的质量分数为7.69%,当B的相对分子质量为118时,含有H原子数为:$\frac{118×7.69%}{1}$=9,而烃B的相对分子质量小于118、反应1为加成反应,故烃B分子中含H原子个数应大于6而小于9,只能为8,B的相对分子量为:$\frac{1×8}{7.69%}$≈104,B分子中含有C原子数为:$\frac{104-8}{12}$=8,所以B的分子式为C8H8,则X为C2H2,即X为乙炔:CH≡CH、B为苯乙烯: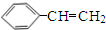 ;B与HBr发生加成反应生成C,则C为
;B与HBr发生加成反应生成C,则C为 ;C与NaOG的水溶液加热反应生成D,则D为
;C与NaOG的水溶液加热反应生成D,则D为 ;D催化氧化生成E,E能够与新制的氢氧化铜反应,则E为
;D催化氧化生成E,E能够与新制的氢氧化铜反应,则E为 ;F与乙醇在浓硫酸作用下发生酯化反应生成G,则G为
;F与乙醇在浓硫酸作用下发生酯化反应生成G,则G为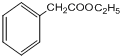 ;G与甲酸乙酯反应生成H,H与氢气发生加成反应生成I,则I为
;G与甲酸乙酯反应生成H,H与氢气发生加成反应生成I,则I为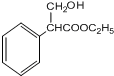 ;I经过反应3生成J,反应的化学方程式为:
;I经过反应3生成J,反应的化学方程式为:

 +H2O,据此进行解答.
+H2O,据此进行解答.
解答 解:烃B中含氢的质量分数为7.69%,当B的相对分子质量为118时,含有H原子数为:$\frac{118×7.69%}{1}$=9,而烃B的相对分子质量小于118、反应1为加成反应,故烃B分子中含H原子个数应大于6而小于9,只能为8,B的相对分子量为:$\frac{1×8}{7.69%}$≈104,B分子中含有C原子数为:$\frac{104-8}{12}$=8,所以B的分子式为C8H8,则X为C2H2,即X为乙炔:CH≡CH、B为苯乙烯: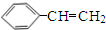 ;B与HBr发生加成反应生成C,则C为
;B与HBr发生加成反应生成C,则C为 ;C与NaOH的水溶液加热反应生成D,则D为
;C与NaOH的水溶液加热反应生成D,则D为 ;D催化氧化生成E,E能够与新制的氢氧化铜反应,则E为
;D催化氧化生成E,E能够与新制的氢氧化铜反应,则E为 ;F与乙醇在浓硫酸作用下发生酯化反应生成G,则G为
;F与乙醇在浓硫酸作用下发生酯化反应生成G,则G为 ;G与甲酸乙酯反应生成H,H与氢气发生加成反应生成I,则I为
;G与甲酸乙酯反应生成H,H与氢气发生加成反应生成I,则I为 ;I经过反应3生成J,
;I经过反应3生成J,
结合各步转化的反应条件及物质的组成与结构可确定C为、D为 、E为
、E为 、G为
、G为 、I为
、I为 ;
;
(1)根据分析可知,B的分子式为:C8H8;X的名称为乙炔,故答案为:C8H8;乙炔;
(2)C→D的反应为:C与NaOH的水溶液加热发生水解反应生成 ,该反应为水解反应,也属于取代反应;G→H 的反应:G与甲酸乙酯发生取代反应生成H,
,该反应为水解反应,也属于取代反应;G→H 的反应:G与甲酸乙酯发生取代反应生成H,
故答案为:水解(或取代)反应;取代反应;
(3)D的结构简式为: ;G的结构简式为:
;G的结构简式为: ,
,
故答案为: ;
; ;
;
(4)反应3为 在浓硫酸存在条件下发生消去反应生成
在浓硫酸存在条件下发生消去反应生成 ,反应的化学方程式为
,反应的化学方程式为

 +H2O,
+H2O,
故答案为:

 +H2O;
+H2O;
(5) 分子中,苯环上含有3种等效H原子,侧链含有3种等效H,总共含有6种H原子,所以其核磁共振氢谱有6个吸收峰,
分子中,苯环上含有3种等效H原子,侧链含有3种等效H,总共含有6种H原子,所以其核磁共振氢谱有6个吸收峰,
故答案为:6;
(6)I为 ,①能发生水解反应和银镜反应,说明有机物分子中含有酯基和醛基;
,①能发生水解反应和银镜反应,说明有机物分子中含有酯基和醛基;
②能与FeCl3溶液发生显色反应,该有机物分子中含有酚羟基;
③苯环上有四个取代基,且苯环上一卤代物只有一种,说明苯环上剩余的2个H为等效H原子,
根据以上分析可知,满足条件的I的同分异构体有: 、
、 、
、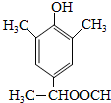 、
、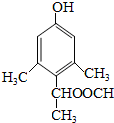 、
、 、
、 ,总共有6种,
,总共有6种,
故答案为:6.
点评 本题考查了有机推断,题目难度较大,熟练掌握常见有机物结构与性质为解答关键,注意明确常见有机反应类型及判断方法,(6)为难点,注意掌握同分异构体的概念及书写原则,试题充分考查了学生的分析能力及逻辑推理能力.

| A. |  观察Fe(OH)2的生成 观察Fe(OH)2的生成 | |
| B. |  配制一定物质的量浓度的NaNO3溶液 配制一定物质的量浓度的NaNO3溶液 | |
| C. |  实验室制取氨 实验室制取氨 | |
| D. |  验证乙烯的生成 验证乙烯的生成 |
| A. | 小苏打可用作糕点的膨化剂 | |
| B. | 二氧化硫可用作食品的漂白剂 | |
| C. | PX(对二甲苯)是生成塑料、聚酯纤维和薄膜的主要原料 | |
| D. | PM2.5指数是雾霾天气监测中的重要指标 |
| A. | H、D、T三种氢的核素在周期表中的位置不同 | |
| B. | 元素简单气态氢化物越稳定,则非金属性越强 | |
| C. | 核外电子层结构相同的离子,核电荷数越大其离子半径也越大 | |
| D. | ⅠA与ⅦA元素形成的化合物都是离子化合物 |
 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(査阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关)
I.电极a表面始终未出现气泡,但产生了银灰色有金属光泽的固体,该电极的电极反应式为:Fe2++2e-=Fe
Ⅱ.电极b开始一段时间内,表面无气泡产生,周围液体出现红褐色,逐渐浑浊.吸取该电极周围少许液体于两支试管中,一支试管中滴入淀粉一KI溶液,液体颜色不变;另一支试管中先加盐酸酸化,再滴入KSCN溶液,巧液变为红色.
结论:电解过程中产生了Fe3+,同时水解产生了红褐色物质.
(1)加盐酸酸化时发生的反应是Fe(OH)3+3H+=Fe3++3H2O(用离子方程式表示)
(2)对电解过程中Fe3+产生的原因进行猜想:
猜想①:Cl-在阳极放电,生成的Cl2将Fe2+氧化成Fe3%
猜想②:Fe2+在阳极直接放电生成Fe3+
猜想③:…
(3)设计实验验证猜想①
供选择的试剂:1mol/LFeS04溶液、lmoi/L 盐酸、2mol/L 盐酸、lmol/LNaCl 溶液、2moJ/L NaCl溶液、淀粉一KI溶液、KSCN溶液,蒸馏水
| 操作 | 现象和结论 |
| ①取-定量2mol/L NaCl溶液,调 节溶液pH为4.91:再以相间装置进行电解. ②电解相同时间后,若电极b表面无气泡,取少量阳极附近的溶液,滴入淀粉KI溶液 | |

| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
| 原子序数 | 元素 | 有关信息 |
 | W | 质子数与Y的最外层电子数相等 |
| X | 最低化合价为-2 | |
| Y | 四种元素种仅有的金属元素 | |
| Z | 与Y的原子序数之和为W、X原子序数之和的3倍 |
(2)X、Z的最简单氢化物是由共价(填“离子”或“共价”)键形成的物质,其中稳定性较弱的氢化物的化学式为H2S.
(3)化合物YXW是由离子键和共价键构成的离子化合物(填“离子”或“共价”)
(4)由W、X、Y、Z四种元素组成的常见化合物的化学式为NaHSO4、NaHSO3,写出这两种物质发生反应的离子方程式:H++HSO3-=SO2↑+H2O.

 溶液出现蓝色且30s内不褪色
溶液出现蓝色且30s内不褪色