题目内容
2.三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用.NF3可在铜的催化作用下由F2和过量NH3反应得到.(1)氟元素基态原子的价电子排布图为
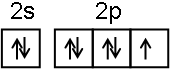 ;NF3中心原子轨道的杂化类型为sp3.
;NF3中心原子轨道的杂化类型为sp3.(2)写出制备NF3的化学方程式:4NH3+3F2$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F.
(3)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用.该物质为配合物,其中心离子是Al3+,配位数为6.该化合物焰色反应火焰呈现黄色.很多金属盐都可以发生焰色反应,其原因是激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量.
分析 (1)氟元素基态原子的价电子排布图为 ;NF3分子中N原子的σ键电子对数为3,孤电子对数为1,所以N原子为杂化sp3;
;NF3分子中N原子的σ键电子对数为3,孤电子对数为1,所以N原子为杂化sp3;
(2)Cu作催化剂,NH3、F2反应生成NF3、NH4F;
(3)HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,设该化合物化学式为R,根据元素守恒知,该物质中含有Na元素、F元素、Al元素,6HF+NaAlO2+2NaCl=2HCl+2H2O+R,根据原子守恒得R化学式为Na3AlF6,由此分析解答.
解答 解:(1)氟元素基态原子的价电子排布图为 ;NF3分子中N原子的σ键电子对数为3,孤电子对数为1,所以N原子为杂化sp3,故答案为:
;NF3分子中N原子的σ键电子对数为3,孤电子对数为1,所以N原子为杂化sp3,故答案为: ; sp3;
; sp3;
(2)Cu作催化剂,NH3、F2反应生成NF3、NH4F,反应方程式为4NH3+3F2$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F,故答案为:4NH3+3F2$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F;
(3)HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,设该化合物化学式为R,根据元素守恒知,该物质中含有Na元素、F元素、Al元素,6HF+NaAlO2+2NaCl=2HCl+2H2O+R,根据原子守恒得R化学式为Na3AlF6,Na3AlF6,中心离子是Al3+;配位数为6;焰色反应火焰呈现黄色;很多金属盐都可以发生焰色反应是因为激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量,故答案为:Al3+;6;黄;激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量.
点评 本题考查物质结构和性质,涉及价电子排布、方程式的书写、化学式的判断等知识点,会根据价层电子对理论确定分子空间构型及原子杂化方式,有一定的难度.

| A. | 硅胶可用作食品干燥剂 | |
| B. | P2O5不可用作食品干燥剂 | |
| C. | 六水合氯化钙可用作食品干燥剂 | |
| D. | 加工后具有吸水性的植物纤维可用作食品干燥剂 |
| A. | 橡皮擦--橡胶工业 | B. | 铝合金片--冶金工业 | ||
| C. | 铅笔芯--电镀工业 | D. | 铅笔漆--涂料工业 |
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片 |

(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3•H2O调节pH=8可除去Fe3+(填离子符号),滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少.
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
已知:2CrO42-+2H+═Cr2O72-+H20 Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的上方(填“上方”或“下方”).BaCl2溶液的浓度为$\frac{b({V}_{0}-{V}_{1})}{y}$mol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将偏大(填“偏大”或“偏小”).
| A. | Na2S溶液中,2c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| B. | 强碱弱酸盐NaA溶液的pH=8,则c(OH-)-c(HA)=1,0×10-8mol/L | |
| C. | KAl(SO4)2溶液中,c(SO42-)>c(K+)=c(Al3+)>c(H+)>c(OH-) | |
| D. | 向100ml pH=12 的 NaOH溶液中加入pH=2的醋酸溶液至中性,所得溶液的总体积大于200ml |
| A. | H、D、T三种氢的核素在周期表中的位置不同 | |
| B. | 元素简单气态氢化物越稳定,则非金属性越强 | |
| C. | 核外电子层结构相同的离子,核电荷数越大其离子半径也越大 | |
| D. | ⅠA与ⅦA元素形成的化合物都是离子化合物 |
| A. |  比较非金属性强弱Cl>C>Si | B. |  制备少量氨气 | ||
| C. |  实验室制氯气 | D. |  实验室制二氧化碳 |

 溶液出现蓝色且30s内不褪色
溶液出现蓝色且30s内不褪色