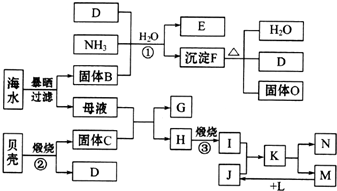
题目内容
12.常温下,对于pH=11的NaOH溶液,下列说法错误的是( )| A. | c(OH-)=c(Na+)+c(H+) | |
| B. | 该溶液中的c(OH-)=1.0×10-3mol•L-1 | |
| C. | 加水稀释104倍所得溶液显碱性 | |
| D. | 与pH=3的HF溶液等体积混合所得溶液:c(Na+)=c(F-)+c(HF) |
分析 A.根据氢氧化钠溶液中的电荷守恒判断;
B.该溶液中的c(H+)=1.0×10-11mol•L-1,结合常温下水的离子积计算出溶液中氢氧根离子浓度;
C.碱溶液稀释后仍然为碱溶液,不可能变成酸性溶液;
D.HF为弱酸,混合液中HF过量,反应后的溶液显示酸性,则c(OH-)<c(H+),再结合电荷守恒判断.
解答 解:A.根据NaOH溶液中的电荷守恒可得:c(OH-)=c(Na+)+c(H+),故A正确;
B.常温下,对于pH=11的NaOH溶液,c(H+)=1.0×10-11mol•L-1,则氢氧根离子浓度为:c(OH-)=$\frac{1×1{0}^{-14}}{1×1{0}^{-11}}$mol/L=1.0×10-3mol•L-1,故B正确;
C.原溶液中的c(OH-)=1.0×10-3mol•L-1,加水稀释104倍所得溶液中氢氧根离子浓度只能接近1.0×10-7mol•L-1,仍然为碱性溶液,故C正确;
D.pH=3的HF溶液中氢离子浓度为1.0×10-11mol•L-1,由于HF为弱电解质,则HF的浓度大于1.0×10-11mol•L-1,所以混合液中HF过量,混合液呈酸性:c(OH-)<c(H+),根据电荷守恒可知:c(Na+)<c(F-),则c(Na+)<c(F-)+c(HF),故D错误;
故选D.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断等知识,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理的含义为解答关键,注意掌握溶液酸碱性与溶液pH的关系及计算方法.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案
相关题目
5.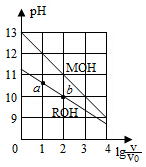 浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )
 浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )| A. | MOH的碱性强于ROH的碱性 | |
| B. | ROH的电离程度:b点大于a点 | |
| C. | 若两溶液无限稀释,则它们的c(OH-)相等 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}$增大 |
6.下列说法不正确的是( )
| A. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| B. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| C. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| D. | 聚合物(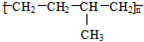 )可由单体CH3CH=CH2和CH2=CH2加聚制得 )可由单体CH3CH=CH2和CH2=CH2加聚制得 |
17.最近媒体报道了一些化学物质,如:爆炸力极强的N5、比黄金还贵的18O、太空中的甲醇气团等.下列说法中正确的是( )
| A. | 18O2和16O2是两种不同的原子 | B. | 甲醇(CH3OH)属于离子化合物 | ||
| C. | N5和N2是氮元素的两种同位素 | D. | 由N5变成N2是化学变化 |
4.化学与生产生活密切相关,下列说法不正确的是( )
| A. | 小苏打可用作糕点的膨化剂 | |
| B. | 二氧化硫可用作食品的漂白剂 | |
| C. | PX(对二甲苯)是生成塑料、聚酯纤维和薄膜的主要原料 | |
| D. | PM2.5指数是雾霾天气监测中的重要指标 |
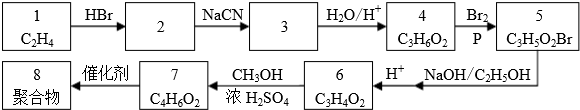
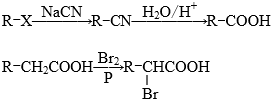
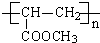 .
.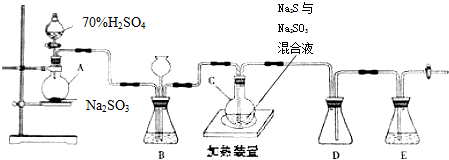
 溶液出现蓝色且30s内不褪色
溶液出现蓝色且30s内不褪色