题目内容
9.元素周期表的第7周期称为不完全周期,若将来发现的元素把第7周期全排满,则下列推论错误的可能性最大的是( )| A. | 该周期有32种元素 | |
| B. | 该周期的元素,原子序数最大为118 | |
| C. | 该周期的ⅦA族元素是金属元素 | |
| D. | 该周期的ⅢA族元素的氢氧化物具有两性 |
分析 A.七周期若排满,容纳32种元素;
B.第七周期若排满,容纳32种元素,根据Ar的原子序数结合各周期容纳的元素种数计算;
C.最外层电子数≤周期数为金属元素,第七周期ⅦA族元素处于金属与非金属性交界处下方;
D.同主族自上而下金属性增强,第七周期的ⅢA族的元素的金属性远比Al强.
解答 解:A.七周期若排满,容纳32种元素,故A正确;
B.第七周期若排满,容纳32种元素,Ar处于第三周期,原子序数为18,可知第七周期中零族元素的原子序数=18+18+18+32+32=118,故B正确;
C.第七周期ⅦA族元素外围电子排布为7s27p5,最外层电子数≤周期数为金属元素,处于金属与非金属性交界处下方,为金属元素,故C正确;
D.同主族自上而下金属性增强,第七周期的ⅢA族的元素的金属性远比Al强,故该元素的氢氧化物碱性远比氢氧化铝强,不可能具有两性,故D错误,
故选D.
点评 本题考查元素周期表与元素周期律,需要学生熟练掌握元素周期表的结构,注意理解同主族元素化合物性质的相似性与递变性、金属元素与非金属性的结构特点.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
19.下列广告语中,你认为符合科学道理的是( )
| A. | “超纯水”、“超纯蒸馏水”绝对卫生,对人体有益 | |
| B. | 含碘食盐可防治甲状腺肿大,但也不能滥补,造成体内碘含量过高 | |
| C. | 本饮料由纯天然物质配置而成,绝对不含化学物质,对人体无害 | |
| D. | 含氟牙膏可适合任何人群预防龋齿 |
20.下列关于氯气的叙述中正确的是( )
| A. | 氯气是一种黄绿色、有毒的气体 | |
| B. | 氯气的密度比空气的小 | |
| C. | 氯气不能溶于水,可以用排水法收集 | |
| D. | 氯气、氯水和液氯是同一种物质 |
4.某温度下,在容积一定的密闭容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol.保持温度不变,向容器中再加入1mol A、0.5mol B和1mol C,则下列说法正确的是( )
| A. | 正、逆反应速率都增大,平衡不移动 | |
| B. | 正、逆反应速率都不变,平衡不移动 | |
| C. | 正、逆反应速率都增大,平衡向左移动 | |
| D. | 正、逆反应速率都增大,平衡向右移动 |
14.为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中可装入的物质是( )
| A. | 无水硫酸铜、蔗糖 | B. | 硅胶、硫酸亚铁 | C. | 食盐、硫酸亚铁 | D. | 生石灰、食盐 |
1.下列有关叙述合理的是( )
| A. | 向澄清石灰水中加入少许NaOH固体,溶液不出现浑浊 | |
| B. | 向饱和Na2CO3溶液中通入CO2气体,一定有浑浊 | |
| C. | 向大量饱和CuSO4溶液中加入16gCuSO4,保持温度不变,析出晶体质量25g | |
| D. | 大量MnO2与含4mol HCl的浓盐酸共热,充分反应后生成Cl2的物质的量小于1mol |
8.将amol纯铁粉投入含HNO3bmol的稀溶液里,恰好完全反应并放出NO气体,则a和b的关系是( )
| A. | $\frac{a}{b}$=$\frac{1}{4}$ | B. | $\frac{a}{b}$=$\frac{3}{8}$ | C. | $\frac{1}{4}$≤$\frac{a}{b}$≤$\frac{3}{8}$ | D. | $\frac{a}{b}$的值无法确定 |
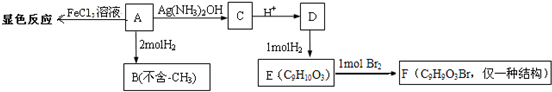
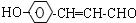 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O,反应类型为氧化反应
+2Ag↓+3NH3+H2O,反应类型为氧化反应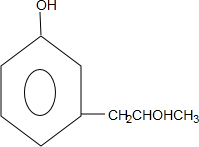 ,G的结构简式
,G的结构简式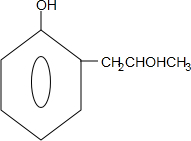 .
.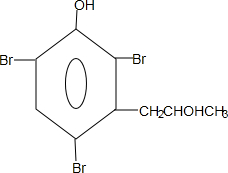 能够溶于有机物,不溶于水,所以在NaOH溶液中出现白色沉淀
能够溶于有机物,不溶于水,所以在NaOH溶液中出现白色沉淀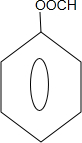 ,
,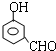 或
或 或
或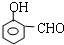 .
.