题目内容
1.下列有关叙述合理的是( )| A. | 向澄清石灰水中加入少许NaOH固体,溶液不出现浑浊 | |
| B. | 向饱和Na2CO3溶液中通入CO2气体,一定有浑浊 | |
| C. | 向大量饱和CuSO4溶液中加入16gCuSO4,保持温度不变,析出晶体质量25g | |
| D. | 大量MnO2与含4mol HCl的浓盐酸共热,充分反应后生成Cl2的物质的量小于1mol |
分析 A、若为饱和氢氧化钙溶液加入氢氧化钠会出现氢氧化钙固体;
B、温度不定,通入二氧化碳气体不一定看到浑浊;
C、取该温度下的饱和溶液200g,再加入16gCuSO4固体,加入的16g硫酸铜会形成结晶水合物全部析出,同时原饱和溶液中由于水的减少,也会析出硫酸铜晶体,依据原溶液中析出的硫酸铜和析出的水是原饱和溶液组成,结合溶解度概念概念计算;
D、MnO2与浓HCl反应,随着反应的进行,浓HCl变稀,稀盐酸不能与MnO2反应,以此解答.
解答 解:A、若是氢氧化钙的饱和溶液,向澄清石灰水中加入少许NaOH固体,依据溶解沉淀平衡分析,平衡逆向进行,出现氢氧化钙沉淀,溶液可以出现浑浊,故A错误;
B、向饱和Na2CO3溶液中通入CO2气体,溶液温度不知,不能判断溶液中是否有沉淀,所以不一定有浑浊.故B错误;
C、取该温度下的饱和溶液200g,再加入16gCuSO4固体,加入的16g硫酸铜会形成结晶水合物全部析出,同时原饱和溶液中由于水的减少,也会析出硫酸铜晶体,依据原溶液中析出的硫酸铜和析出的水是原饱和溶液组成,设析出硫酸铜晶体CuSO4•5H2O质量为xg,则
则($\frac{160}{250}$x-16):$\frac{90}{250}$x=25:100,解得x≈29g,故C错误;
D、实验室制取氯气的化学方程式为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,假设含HCl为4mol的浓盐酸能完全反应,则生成氯气为1mol,而MnO2不能氧化稀盐酸,随着反应的进行,浓HCl变稀,稀盐酸不能与MnO2反应,故反应中产生的氯气小于1mol,故D正确;
故选D.
点评 本题考查了饱和溶液中溶质的溶解度分析判断,晶体析出质量的计算应用,注意溶液浓度变化反应产物的判断,掌握反应过程是解题关键,题目难度中等.

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 标准状况下,11.2 LNH3中含有的电子数为5NA | |
| D. | 常温常压下,22.4L氯气与足量铁粉充分反应,转移的电子数为2NA |
| A. | 硅是良好的半导体材料,可以与NaOH 溶液和氢氟酸反应 | |
| B. | 二氧化硅与石灰石反应:SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO↑ | |
| C. | 用焦炭还原二氧化硅生产硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO2↑ | |
| D. | 工业制造镁粉是将镁蒸气在某气体中冷却,CO2可作为冷却气体. |
| A. | 该周期有32种元素 | |
| B. | 该周期的元素,原子序数最大为118 | |
| C. | 该周期的ⅦA族元素是金属元素 | |
| D. | 该周期的ⅢA族元素的氢氧化物具有两性 |
| A. | 3:1 | B. | 1:3 | C. | 2:3 | D. | 4:1 |
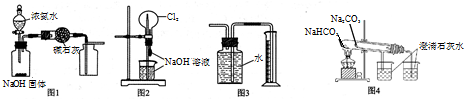
| A. | 图1装置可制取、收集干燥纯净的NH3 | |
| B. | 图2装置可以完成“喷泉”实验 | |
| C. | 图3装置可测量Cu 与浓硝酸反应产生气体的体积 | |
| D. | 图4装置可用比较NaHCO3和Na2CO3的热稳定性 |
【反应原理】
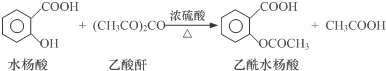
【物质性质】
| 试剂 | 沸点(℃) | 溶解度 | 化学性质 |
| 水杨酸 | 211 | 微溶于冷水,易溶于热水 | |
| 乙酸酐 | 139 | 在水中逐渐分解 | |
| 乙酰水杨酸 | 微溶于水 | 与碳酸钠反应生成水溶性盐 |
(1)物质制备:向125mL的锥形瓶中依次加入4g水杨酸、10mL乙酸酐、0.5mL浓硫酸,振荡锥形瓶至水杨酸全部溶解,在85℃~90℃条件下,用热水浴加热5~10min.
①加入水杨酸、乙酸酐后,需缓慢滴加浓硫酸,否则产率会大大降低,其原因是水杨酸属于酚类物质,会被浓H2SO4氧化.
②控制反应温度85℃~90℃的原因既保证有较高的反应速率又减少了物质的挥发.
(2)产品结晶:取出锥形瓶,加入50mL蒸馏水冷却.待晶体完全析出后用布氏漏斗抽滤,再洗涤晶体,抽干.简要叙述如何洗涤布氏漏斗中的晶体?向布氏漏斗中加入冰水至浸没所有晶体,再抽滤,重复2~3次.
(3)产品提纯:将粗产品转移至150mL烧杯中,向其中慢慢加入试剂X并不断搅拌至不再产生气泡为止.进一步提纯最终获得乙酰水杨酸3.6g.
①试剂X为饱和碳酸钠溶液.
②实验中乙酰水杨酸的产率为69%(已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180).
(4)纯度检验:取少许产品加入盛有5mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色,其可能的原因是产品中仍然可能含有水杨酸.
| A. | 单质的熔点、沸点高低 | |
| B. | 非金属之间发生的置换反应 | |
| C. | 非金属与氢气生成气态氢化物的难易程度 | |
| D. | 非金属元素的最高价氧化物的水化物的酸性强弱 |
| A. | sp-s | B. | sp2-s | C. | sp2-p | D. | sp3-s |