题目内容
7.硝酸钾用途广泛,工业上一般用复分解反应制取硝酸钾(相关物质的溶解度曲线如图2见下表).以硝酸钠和氯化钾为原料制备硝酸钾的工艺流程如图1: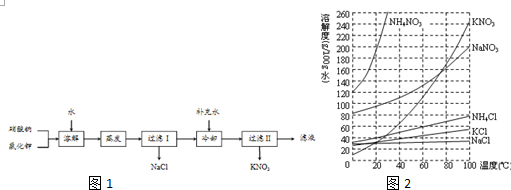
完成下列填空:
(1)为了加速固体溶解,可采取的措施有加热、搅拌、研细颗粒等(至少写两种);实验室进行蒸发结晶操作时,为了防止液滴飞溅,进行的操作是用玻璃棒不断搅拌滤液.
(2)过滤I所得滤液中含有的离子是K+、NO3-、Na+、Cl-;过滤I所得滤液在进行冷却结晶前应补充少量水,目的是减少NaCl的结晶析出.
(3)检验产品KNO3中杂质的方法是取少量固体溶于水,加入硝酸酸化的硝酸银溶液,若生成白色沉淀说明含有杂质.
实验室模拟工业上用氯化钾和硝酸铵为原料制取硝酸钾的过程如下:取40g NH4NO3和37.25g KCl固体加入100g水中,加热至90℃,固体溶解,用冰水浴冷却至5℃以下,过滤(a).在滤液中再加入NH4NO3,加热蒸发,当体积减小到约原来的$\frac{2}{3}$时,保持70℃过滤(b),滤液可循环使用.完成下列填空:
(4)过滤(a)得到的固体物质主要是KNO3;在滤液中再加入NH4NO3的目的是增大铵根离子的浓度,有利于氯化铵结晶析出.
(5)为检测硝酸钾样品中铵盐含量,称取1.564g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00mL 0.102mol/L H2SO4溶液全部吸收,滴定过量的H2SO4用去0.089mol/L标准NaOH溶液16.55mL.
滴定过程中使用的指示剂是甲基橙;样品中含铵盐(以氯化铵计)的质量分数是8.92%(保留3位数).
分析 硝酸钠和氯化钾用水溶解,由于溶液中NaCl的溶解度最小,且受温度影响不大,采取蒸发浓缩,析出NaCl晶体,再过滤分离,由于硝酸钾溶解度受温度影响比硝酸钠大,采取冷却结晶析出硝酸钾,浓缩析出NaCl晶体,直接冷却为继续析出NaCl晶体,故滤液中先加入水,再冷却析出硝酸钾,过滤分离.
(1)加热、搅拌、研细颗粒等都可以加快物质溶解;实验室进行蒸发结晶操作时,用玻璃棒不断搅拌滤液,使溶液受热均匀,防止液滴飞溅;
(2)过滤I后析出部分NaCl,溶液中含有硝酸钠、KCl电离产生的离子;氯化钠溶解度最小,浓缩析出NaCl晶体,直接冷却为继续析出NaCl晶体;
(3)产品KNO3中可能含有Na+、Cl-杂质离子,用硝酸酸化的硝酸银溶液检验氯离子即可,焰色反应检验钠离子;
(4)取40g NH4NO3和37.25g KCl固体加入100g水中,加热至90℃,固体溶解,用冰水浴冷却至5℃以下,由于硝酸钾的溶解度最小,则会析出硝酸钾晶体;在滤液中加入硝酸铵可以增大铵根离子浓度,有利于氯化铵的析出;
(5)恰好反应时溶质为硫酸钠、硫酸铵,溶液呈酸性,指示剂变色范围应在酸性中,根据滴定数据计算出氨气的物质的量,再计算出氯化铵的质量分数.
解答 解:硝酸钠和氯化钾用水溶解,由于溶液中NaCl的溶解度最小,且受温度影响不大,采取蒸发浓缩,析出NaCl晶体,再过滤分离,由于硝酸钾溶解度受温度影响比硝酸钠大,采取冷却结晶析出硝酸钾,浓缩析出NaCl晶体,直接冷却为继续析出NaCl晶体,故滤液中先加入水,再冷却析出硝酸钾,过滤分离.
(1)加热、搅拌、研细颗粒等都可以加快物质溶解;实验室进行蒸发结晶操作时,用玻璃棒不断搅拌滤液,使溶液受热均匀,防止液滴飞溅,
故答案为:加热、搅拌、研细颗粒等;用玻璃棒不断搅拌滤液;
(2)过滤I后析出部分NaCl,滤液I含有K+、NO3-、Na+、Cl-;氯化钠溶解度最小,浓缩析出NaCl晶体后,直接冷却会继续析出NaCl晶体,在进行冷却结晶前应补充少量水,可以减少NaCl的结晶析出,
故答案为:K+、NO3-、Na+、Cl-;减少NaCl的结晶析出;
(3)产品KNO3中可能含有Na+、Cl-杂质离子,取少量固体溶于水,加入硝酸酸化的硝酸银溶液,若生成白色沉淀说明含有杂质,
故答案为:取少量固体溶于水,加入硝酸酸化的硝酸银溶液,若生成白色沉淀说明含有杂质;
(4)取40g NH4NO3和37.25g KCl固体加入100g水中,加热至90℃所有固体均溶解,用冰水浴冷却至5℃以下时,硝酸钾的溶解度最小,首先析出的是硝酸钾晶体;在滤液中加入硝酸铵可以增大铵根离子浓度,使NH4Cl晶体析出,
故答案为:KNO3;增大铵根离子的浓度,有利于氯化铵结晶析出;
(5)由于恰好反应时生成的溶质为硫酸铵和硫酸钠,溶液为酸性,则应该选用甲基橙为指示剂;
硫酸总的物质的量为:0.102mol/L×0.02L=0.00204mol,含有氢离子的物质的量为0.00408mol,
氢氧化钠的物质的量为:0.089mol/L×0.01655L=0.001473mol,
所以氨气的物质的量为:0.00408mol-0.001473mol=0.002607mol,
样品中氯化铵的物质的量为0.002607mol,
则样品中氯化铵的质量分数为:$\frac{0.002607mol×53.5g/mol}{1.564g}$×100%≈8.92%,
故答案为:甲基橙;8.92%.
点评 本题考查物质制备方案、物质的分离与提纯方法,涉及溶解度曲线的理解与应用、滴定计算等,关键是对原理的理解,试题培养了学生灵活应用所学知识的能力,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 该周期有32种元素 | |
| B. | 该周期的元素,原子序数最大为118 | |
| C. | 该周期的ⅦA族元素是金属元素 | |
| D. | 该周期的ⅢA族元素的氢氧化物具有两性 |
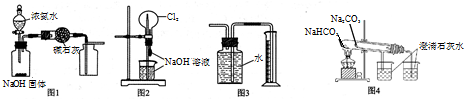
| A. | 图1装置可制取、收集干燥纯净的NH3 | |
| B. | 图2装置可以完成“喷泉”实验 | |
| C. | 图3装置可测量Cu 与浓硝酸反应产生气体的体积 | |
| D. | 图4装置可用比较NaHCO3和Na2CO3的热稳定性 |
【反应原理】
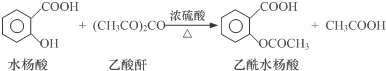
【物质性质】
| 试剂 | 沸点(℃) | 溶解度 | 化学性质 |
| 水杨酸 | 211 | 微溶于冷水,易溶于热水 | |
| 乙酸酐 | 139 | 在水中逐渐分解 | |
| 乙酰水杨酸 | 微溶于水 | 与碳酸钠反应生成水溶性盐 |
(1)物质制备:向125mL的锥形瓶中依次加入4g水杨酸、10mL乙酸酐、0.5mL浓硫酸,振荡锥形瓶至水杨酸全部溶解,在85℃~90℃条件下,用热水浴加热5~10min.
①加入水杨酸、乙酸酐后,需缓慢滴加浓硫酸,否则产率会大大降低,其原因是水杨酸属于酚类物质,会被浓H2SO4氧化.
②控制反应温度85℃~90℃的原因既保证有较高的反应速率又减少了物质的挥发.
(2)产品结晶:取出锥形瓶,加入50mL蒸馏水冷却.待晶体完全析出后用布氏漏斗抽滤,再洗涤晶体,抽干.简要叙述如何洗涤布氏漏斗中的晶体?向布氏漏斗中加入冰水至浸没所有晶体,再抽滤,重复2~3次.
(3)产品提纯:将粗产品转移至150mL烧杯中,向其中慢慢加入试剂X并不断搅拌至不再产生气泡为止.进一步提纯最终获得乙酰水杨酸3.6g.
①试剂X为饱和碳酸钠溶液.
②实验中乙酰水杨酸的产率为69%(已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180).
(4)纯度检验:取少许产品加入盛有5mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色,其可能的原因是产品中仍然可能含有水杨酸.
| A. | 单质的熔点、沸点高低 | |
| B. | 非金属之间发生的置换反应 | |
| C. | 非金属与氢气生成气态氢化物的难易程度 | |
| D. | 非金属元素的最高价氧化物的水化物的酸性强弱 |
| A. | 在测定中和反应的反应热实验中,要读取最高温度 | |
| B. | 中和滴定实验中,洗净后的锥形瓶不需要干燥 | |
| C. | 向CH3COONa溶液中滴入石蕊试液,溶液变蓝 | |
| D. | 向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS) |
| A. | 22.4LH2 中含分子数为NA | |
| B. | 46gNO2 和N2O4混合气体中含有原子数为3NA | |
| C. | 1L1mol/L氨水溶液中离子总数为2NA | |
| D. | 1L2mol/L氯化铵溶液中有2NA个NH4+离子 |


 ,D的化学名称是丙酮.
,D的化学名称是丙酮. .
. .
. (填结构简式).
(填结构简式).