题目内容
4.某温度下,在容积一定的密闭容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol.保持温度不变,向容器中再加入1mol A、0.5mol B和1mol C,则下列说法正确的是( )| A. | 正、逆反应速率都增大,平衡不移动 | |
| B. | 正、逆反应速率都不变,平衡不移动 | |
| C. | 正、逆反应速率都增大,平衡向左移动 | |
| D. | 正、逆反应速率都增大,平衡向右移动 |
分析 若保持温度不变,向容器中再加入1mol A、0.5mol B和1mol C,可以等效为在原平衡的基础上增大压强到达的平衡,正反应为气体体积减小的反应,与原平衡相比,增大压强平衡向正反应方向移动,正逆反应速率都加快,由此分析解答.
解答 解:A、增大压强,正、逆反应速率都增大,平衡正向移动,而不是不移动,故A错误;
B、增大压强,正、逆反应速率都增大,并不是不变,平衡正向移动,而不是不移动,故B错误;
C、正、逆反应速率都增大,平衡向右移动,故C错误;
D、增大压强,正、逆反应速率都增大,平衡正向移动,故D正确;
故选D.
点评 本题考查化学平衡的有关计算、影响化学平衡的因素,难度中等,构建平衡建立的途径是关键,注意等效思想的运用.

练习册系列答案
相关题目
14.在反应MnO2+4HCl(浓)△_MnCl2+2H2O+Cl2↑中,当有8.7gMnO2参加反应时,下列说法正确的是( )
| A. | 被氧化的HCl为0.4mol | B. | 转移的电子数为0.2NA | ||
| C. | 该反应中HCl只作还原剂 | D. | Cl2为还原产物 |
15.下列说法不正确的是( )
| A. | 纳米材料是指一种称为“纳米”的新物质制成的材料 | |
| B. | 绿色食品是指不含任何化学物质的食品 | |
| C. | 光导纤维是以二氧化硅为主要原料制成的 | |
| D. | 合成纤维的主要原料是石油、天然气、煤 |
12.关于硅及其化合物的叙述中,正确的是( )
| A. | 硅是良好的半导体材料,可以与NaOH 溶液和氢氟酸反应 | |
| B. | 二氧化硅与石灰石反应:SiO2+CaCO3高温_CaSiO3+CO↑ | |
| C. | 用焦炭还原二氧化硅生产硅:SiO2+2C高温_Si+2CO2↑ | |
| D. | 工业制造镁粉是将镁蒸气在某气体中冷却,CO2可作为冷却气体. |
9.元素周期表的第7周期称为不完全周期,若将来发现的元素把第7周期全排满,则下列推论错误的可能性最大的是( )
| A. | 该周期有32种元素 | |
| B. | 该周期的元素,原子序数最大为118 | |
| C. | 该周期的ⅦA族元素是金属元素 | |
| D. | 该周期的ⅢA族元素的氢氧化物具有两性 |
16.用初中电解水的实验装置电解水和重水(D2O)组成的混合液,通电一段时间后,在两极共收集到33.6L(标准状况)气体,总质量为18.5g,则混合气体中H原子和D原子个数之比( )
| A. | 3:1 | B. | 1:3 | C. | 2:3 | D. | 4:1 |
2.工业上常用水杨酸与乙酸酐反应制取解热镇痛药阿司匹林(乙酰水杨酸).
【反应原理】
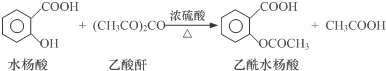
【物质性质】
【实验流程】
(1)物质制备:向125mL的锥形瓶中依次加入4g水杨酸、10mL乙酸酐、0.5mL浓硫酸,振荡锥形瓶至水杨酸全部溶解,在85℃~90℃条件下,用热水浴加热5~10min.
①加入水杨酸、乙酸酐后,需缓慢滴加浓硫酸,否则产率会大大降低,其原因是水杨酸属于酚类物质,会被浓H2SO4氧化.
②控制反应温度85℃~90℃的原因既保证有较高的反应速率又减少了物质的挥发.
(2)产品结晶:取出锥形瓶,加入50mL蒸馏水冷却.待晶体完全析出后用布氏漏斗抽滤,再洗涤晶体,抽干.简要叙述如何洗涤布氏漏斗中的晶体?向布氏漏斗中加入冰水至浸没所有晶体,再抽滤,重复2~3次.
(3)产品提纯:将粗产品转移至150mL烧杯中,向其中慢慢加入试剂X并不断搅拌至不再产生气泡为止.进一步提纯最终获得乙酰水杨酸3.6g.
①试剂X为饱和碳酸钠溶液.
②实验中乙酰水杨酸的产率为69%(已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180).
(4)纯度检验:取少许产品加入盛有5mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色,其可能的原因是产品中仍然可能含有水杨酸.
【反应原理】

【物质性质】
| 试剂 | 沸点(℃) | 溶解度 | 化学性质 |
| 水杨酸 | 211 | 微溶于冷水,易溶于热水 | |
| 乙酸酐 | 139 | 在水中逐渐分解 | |
| 乙酰水杨酸 | 微溶于水 | 与碳酸钠反应生成水溶性盐 |
(1)物质制备:向125mL的锥形瓶中依次加入4g水杨酸、10mL乙酸酐、0.5mL浓硫酸,振荡锥形瓶至水杨酸全部溶解,在85℃~90℃条件下,用热水浴加热5~10min.
①加入水杨酸、乙酸酐后,需缓慢滴加浓硫酸,否则产率会大大降低,其原因是水杨酸属于酚类物质,会被浓H2SO4氧化.
②控制反应温度85℃~90℃的原因既保证有较高的反应速率又减少了物质的挥发.
(2)产品结晶:取出锥形瓶,加入50mL蒸馏水冷却.待晶体完全析出后用布氏漏斗抽滤,再洗涤晶体,抽干.简要叙述如何洗涤布氏漏斗中的晶体?向布氏漏斗中加入冰水至浸没所有晶体,再抽滤,重复2~3次.
(3)产品提纯:将粗产品转移至150mL烧杯中,向其中慢慢加入试剂X并不断搅拌至不再产生气泡为止.进一步提纯最终获得乙酰水杨酸3.6g.
①试剂X为饱和碳酸钠溶液.
②实验中乙酰水杨酸的产率为69%(已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180).
(4)纯度检验:取少许产品加入盛有5mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色,其可能的原因是产品中仍然可能含有水杨酸.
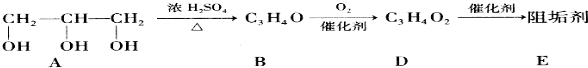
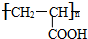 ;其反应类型为加聚反应;
;其反应类型为加聚反应;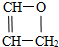 .
.