题目内容
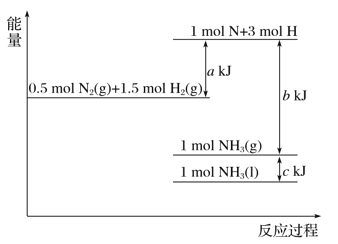
【题目】(1)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g) =2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g) =2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g) =3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:__________。
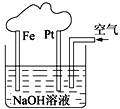
(2)化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解NO3—的原理如图所示。

①电源正极为____(填“A”或“B”),阴极的电极反应式为___________________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为___g。
【答案】CO(g) + FeO(s) = Fe(S) + CO2(g) ΔH = - 218kJ/ mol A 2NO3- + 10e- + 12H+ = N2↑ + 6H2O 14.4
【解析】
(1)由盖斯定律可知,反应CO(g)+FeO(s)═Fe(s)+CO2(g)可由[①×3(②+③×2)]/6得到。
(2)由题给原理图知,Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,电极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-,则B为负极,A为电源正极,Pt电极为电解池的阳极,电极反应式为:2H2O-4e-=4H++O2↑。
(1)由盖斯定律可知,[(②+③×2) ①×3]/6得到反应CO(g)+FeO(s)═Fe(s)+CO2(g)△H=(—24.8 KJ/mol×3) [ (―47.2kJ/mol)+(+640.4×2)]/6 =-218 kJ/ mol,故答案为:CO(g) + FeO(s) = Fe(S) + CO2(g) ΔH = - 218kJ/ mol;
(2)①由题给原理图知,Ag-Pt电极上NO3-发生还原反应,电极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-,因此Ag-Pt电极为阴极,则B为负极,A为电源正极,Pt电极为电解池的阳极,故答案为:A;电极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-;
②由阳极电极反应式2H2O-4e-=4H++O2↑知,转移2mol电子时,阳极区消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故膜两侧电解液的质量变化差(△m左-△m右)=14.4g,故答案为:14.4。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】铜阳极泥(主要含有铜、银、金、少量的镍)是有色金属治炼过程中重要的“二次资源”。其合理处理对于实现资源的综合利用具有重要意义。一种从铜阳极泥中分离提取多种金属元素的工艺流程如下
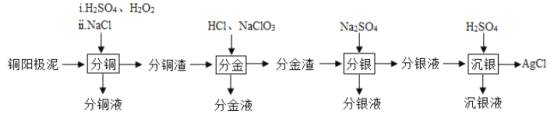
已知:分金液的主要成分为[AuCl4]—;分金渣的主要成分为AgCl;分银液中主要成分为Ag(SO3)2]3—,且存在[Ag(SO3)2]3—![]() Ag++2SO32—
Ag++2SO32—
(1)“分铜”时,单质铜发生反应的化学方程式为_______________________。已知“分铜”时各元素的浸出率如下表所示。
Cu | Au | Ag | Ni | |
浸出率% | 85.7 | 0 | 4.5 | 93.5 |
“分铜”时加入足量的NaC1的主要作用为_________________________________。
(2)“分金”时,单质金发生反应的离子方程式为__________________________。
(3)某小组模拟工业上回收分银渣中的银,过程如下:
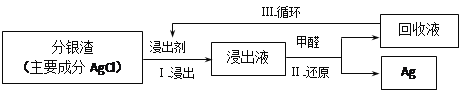
中主要反应:AgCl+2SO32—![]() Ag(SO3)23—+C1—
Ag(SO3)23—+C1—
①研究发现:其他条件不变时,该反应在敞口容器中进行,浸出时间过长会使银的浸出率(浸出液中银的质量占起始分银渣中银的质量的百分比)降低,可能原因是____________________。
②将Ⅱ中反应的离子方程式补充完整:
_____Ag(SO3)23-+_____OH—+_____==_____+_____SO32—+_____+CO32—
③中回收液可直接循环使用,但循环多次后,银的浸出率会降低。从回收液离子浓度变化和反应限度的角度分析原因:________________________________________。
(4)工业上,粗银电解精炼时,电解质溶液的pH为1.5~2,电流为5~10A,若用7A的电流电解60min后,得到21.6gAg,则该电解池的电解效率为________%。(保留小数点后位。通过一定电荷量时阴极上实际沉积的金属质量与理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C·mol—1)