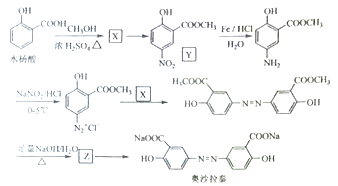
题目内容
【题目】I.有200 mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol·L-1,c(Cl-)为1.3mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4mol·L-1NaOH溶液的体积为___________________mL
II.焊接铜件时常用的焊药为氯化铵,其作用是消除焊接处的氧化铜。其反应式为 NH4C1+ CuO→Cu+CuCl2+ N2↑+ H2O
(1)配平,并用双线桥法标出电子转移情况。:____________
(2)该反应中,氧化剂和还原剂的物质的量之比为:___________。
(3)若反应中电子转移了0.3mol,则产生的气体在标准状况下的体积为_______L。
【答案】80.0 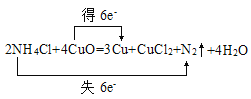 3∶2 1.12
3∶2 1.12
【解析】
I.根据电荷守恒计算混合溶液中n(Al3+),向MgCl2和AlCl3的混合溶液加入NaOH溶液,使Mg2+全部转化为沉淀分离出来,Al3+应恰好转化为![]() ,反应后溶液为NaCl、NaAlO2的混合液,根据钠离子守恒n(NaOH)=n(NaCl)+n(NaAlO2),再结合氯离子守恒、Al原子守恒可知n(NaOH)=n(Cl-)+n(Al3+),再根据
,反应后溶液为NaCl、NaAlO2的混合液,根据钠离子守恒n(NaOH)=n(NaCl)+n(NaAlO2),再结合氯离子守恒、Al原子守恒可知n(NaOH)=n(Cl-)+n(Al3+),再根据![]() 计算;
计算;
II.(1)根据Cu元素的化合价降低、N元素的化合价升高,利用电子守恒及质量守恒定律来配平反应;
(2)该反应中氧化剂为CuO,还原剂为NH4Cl,由(1)中双线桥可知,氧化剂和还原剂的物质的量之比为3:2;
(3)生成1个N2分子转移电子数为6,若反应中电子转移了0.3mol,则产生的N2的物质的量为![]() =0.05mol,带入V=nVm计算。
=0.05mol,带入V=nVm计算。
I.溶液中n(Cl)=0.2L×1.3mol/L=0.26mol,
溶液中n(Mg2+)=0.2mol/L×0.2L=0.04mol,
根据电荷守恒,溶液中n(Al3+)=![]() =0.06mol,
=0.06mol,
将200mL此溶液中的Mg2+转化为Mg(OH)2沉淀并分离析出,反应后溶液为NaCl、NaAlO2的混合液,根据钠离子守恒:n(NaOH)=n(NaCl)+n(NaAlO2),再结合氯离子守恒、Al原子守恒可知:n(NaOH)=n(Cl)+n(Al3+)=0.26mol+0.06mol=0.32mol,所以至少需要4mol/L氢氧化钠溶液的体积为:![]() =0.08L=80mL;
=0.08L=80mL;
II.(1)根据Cu元素的化合价由+2价降至0价,得到2mol电子生成1molCu,N元素的化合价由-3价升至0价,失去6mol电子生成1molN2,利用电子守恒及质量守恒定律来配平反应得2NH4Cl+4CuO=3Cu+CuCl2+N2↑+4H2O,双线桥法标出电子转移情况为: ;
;
(2)该反应中氧化剂为CuO,还原剂为NH4Cl,由(1)中双线桥可知,4molCuO参与反应,做氧化剂的为3mol,氧化剂和还原剂的物质的量之比为3:2;
(3)生成1个N2分子转移电子数为6,若反应中电子转移了0.3mol,则产生的N2的物质的量为![]() =0.05mol,则产生的N2在标准状况下的体积V=nVm=0.05mol×22.4L/mol=1.12L。
=0.05mol,则产生的N2在标准状况下的体积V=nVm=0.05mol×22.4L/mol=1.12L。