题目内容
【题目】常温下将NaOH溶液滴加到已二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )。

A. 常温下Ka1(H2X)的值约为10-4.4
B. 曲线N表示pH与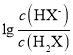
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)
【答案】D
【解析】
H2X为二元弱酸,以第一步电离为主,则Ka1(H2X)>Ka2(H2X),在酸性条件下,当pH相同时, >
> 。根据图象可知N为lg
。根据图象可知N为lg 的变化曲线,M为lg
的变化曲线,M为lg 的变化曲线,当lg
的变化曲线,当lg =0或lg
=0或lg =0时,说明
=0时,说明 =1或
=1或 =1.浓度相等,结合图象可计算电离平衡常数并判断溶液的酸碱性。
=1.浓度相等,结合图象可计算电离平衡常数并判断溶液的酸碱性。
A. lg =0时,
=0时, =1,此时溶液的pH≈4.4,所以Ka1(H2X)=c(H+)=10-4.4,A正确;
=1,此时溶液的pH≈4.4,所以Ka1(H2X)=c(H+)=10-4.4,A正确;
B.根据上述分析可知曲线B表示lg 的变化曲线,B正确;
的变化曲线,B正确;
C.根据图象可知:当lg =0时,
=0时, =1,即c(HX-)=c(X2-),此时溶液的pH约等于5.4<7,溶液显酸性,说明该溶液中c(H+)>c(OH-),C正确;
=1,即c(HX-)=c(X2-),此时溶液的pH约等于5.4<7,溶液显酸性,说明该溶液中c(H+)>c(OH-),C正确;
D.根据图象可知当溶液pH=7时,lg >0,说明c(X2-)>c(HX-),因此该溶液中c(Na+)>c(X2-)>c(HX-)> c(OH-),D 错误;
>0,说明c(X2-)>c(HX-),因此该溶液中c(Na+)>c(X2-)>c(HX-)> c(OH-),D 错误;
故合理选项是D。

【题目】设反应①Fe(s) + CO2(g) ![]() FeO(s) + CO(g) 的平衡常数为K1,反应②Fe(s) + H2O(g)
FeO(s) + CO(g) 的平衡常数为K1,反应②Fe(s) + H2O(g)![]() FeO(s) + H2(g) 的平衡常数为K2。在不同温度下,K1和K2的值如下:
FeO(s) + H2(g) 的平衡常数为K2。在不同温度下,K1和K2的值如下:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
(1)现有反应③ H2(g) + CO2(g) ![]() H2O(g) + CO(g),写出该反应的平衡常数K3的数学表达式K3=______________,根据反应①与②,可推导出K1、K2和K3之间的关系式为______________。
H2O(g) + CO(g),写出该反应的平衡常数K3的数学表达式K3=______________,根据反应①与②,可推导出K1、K2和K3之间的关系式为______________。
(2)从上表和K1、K2和K3之间的关系可以推断:反应①是___________(填“吸”、“ 放”,下同)热反应,反应③是___________热反应。
(3)图表示该反应③在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的情况:

①图中时刻t2时改变的条件是_________(写出一种即可),
②973K时测得反应①中CO2和CO 的浓度分别为0.025mol/L和0.1mol/L,此时反应①是否处于化学平衡状态_______(选填“是”或“否”), 化学反应速度υ(正)_________υ(逆)(选填“>”、“<”或“=”)。


