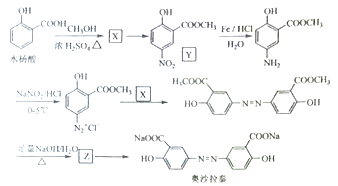
题目内容
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素。Y和Z位于同一周期,可组成中学常见的共价化合物YZ和YZ2,X和Z最外层电子数之和与W的最外层电子数相同,25℃0.01mol·L-1 X和W形成化合物的水溶液pH为2,下列说法正确的是
A. Y元素的非金属性大于W元素
B. X和Y可以形成既含极性键又含非极性键的分子
C. YZ和YZ2均可以被NaOH溶液直接吸收
D. X和W形成的化合物中各原子均为8电子稳定结构
【答案】B
【解析】
X、Y、Z、W是原子序数依次增大的四种短周期元素,25℃时0.01mol/LX和W形成化合物的水溶液pH为2,则二者形成的化合物是一元强酸,则X是H元素、W是Cl元素;Y和Z位于同一周期,可组成中学常见的共价化合物YZ和YZ2,X和Z的原子最外层电子数之和等于W的原子最外层电子数,则Z最外层电子数是6,Z为O元素,Y为C元素,据此分析解题。
X、Y、Z、W是原子序数依次增大的四种短周期元素,25℃时0.01mol/LX和W形成化合物的水溶液pH为2,则二者形成的化合物是一元强酸,则X是H元素、W是Cl元素;Y和Z位于同一周期,可组成中学常见的共价化合物YZ和YZ2,X和Z的原子最外层电子数之和等于W的原子最外层电子数,则Z最外层电子数是6,Z为O元素,Y为C元素;
A.Y是C、W是Cl元素,Cl元素的非金属性比C元素强,故A错误;
B.X为H、Y为C,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,X和Y能形成既含极性键又含非极性键的分子,如含有多个碳原子的烃,故B正确;
C.Y是C、Z是O元素,CO2能被NaOH溶液吸收,而CO不与NaOH溶液反应,故C错误;
D.X是H、W是Cl元素,两者形成的化合物HCl的电子式为![]() ,可知H元素形成的是2个电子的稳定结构,故D错误;
,可知H元素形成的是2个电子的稳定结构,故D错误;
故答案为B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案