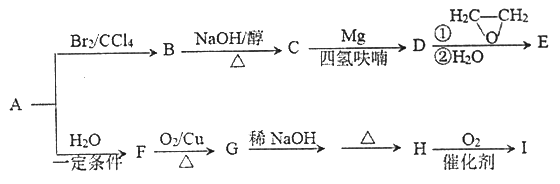
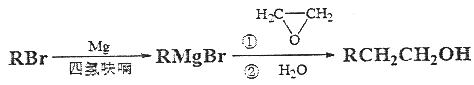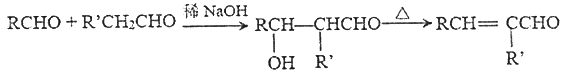题目内容
【题目】根据能量变化示意图,下列热化学方程式正确的是( )

A. N2(g)+3H2(g)===2NH3(g) ΔH=-(b-a) kJ·mol-1
B. N2(g)+3H2(g)===2NH3(g) ΔH=-(a-b) kJ·mol-1
C. 2NH3(l)===N2(g)+3H2(g) ΔH=2(a+b-c) kJ·mol-1
D. 2NH3(l)===N2(g)+3H2(g) ΔH=2(b+c-a) kJ·mol-1
【答案】D
【解析】由图可知,![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g)△H=(a-b)kJmol-1,
H2(g)=NH3(g)△H=(a-b)kJmol-1,![]() N2(g)+
N2(g)+![]() H2(g)=NH3(l)△H=(a-b-c)kJmol-1。A.N2(g)+3H2(g)=2NH3(g)△H=-2(b-a)kJmol-1,故A错误;B.N2(g)+3H2(g)=2NH3(g)△H═-2(b-a)kJmol-1,故B错误;C.物质的量与热量成正比、互为可逆反应的焓变的数值相同而符号相反,则2NH3(1)=N2(g)+3H2(g)△H=2(-a+b+c)kJmol-1,故C错误;D.结合选项C可知,2NH3(1)=N2(g)+3H2(g)△H=2(b+c-a)kJmol-1,故D正确;故选D。
H2(g)=NH3(l)△H=(a-b-c)kJmol-1。A.N2(g)+3H2(g)=2NH3(g)△H=-2(b-a)kJmol-1,故A错误;B.N2(g)+3H2(g)=2NH3(g)△H═-2(b-a)kJmol-1,故B错误;C.物质的量与热量成正比、互为可逆反应的焓变的数值相同而符号相反,则2NH3(1)=N2(g)+3H2(g)△H=2(-a+b+c)kJmol-1,故C错误;D.结合选项C可知,2NH3(1)=N2(g)+3H2(g)△H=2(b+c-a)kJmol-1,故D正确;故选D。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】下列图中的实验方案,能达到实验目的的是( )
A | B | C | D | |
实验方案 |
|
将NO2球浸泡在冰水和热水中 |
|
|
实验 目的 | 验证FeCl3对H2O2 分解反应有催化作用 | 探究温度对平衡 2NO2 | 除去CO2气体中混有的SO2 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
A. A B. B C. C D. D
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g)![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是
A. 上述生成Ni(CO)4(g)的反应为放热反应
B. 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时V(正)>V(逆)
C. 25℃时反应Ni(CO)4(g)![]() Ni(s)+4CO(g)的平衡常数为2×10-5 (mol·L-1)3
Ni(s)+4CO(g)的平衡常数为2×10-5 (mol·L-1)3
D. 80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度2 mol/L。