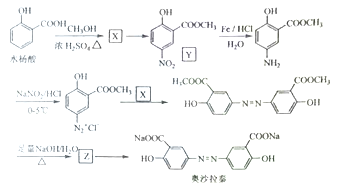
题目内容
【题目】铜阳极泥(主要含有铜、银、金、少量的镍)是有色金属治炼过程中重要的“二次资源”。其合理处理对于实现资源的综合利用具有重要意义。一种从铜阳极泥中分离提取多种金属元素的工艺流程如下
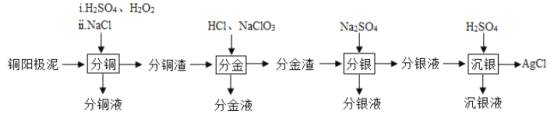
已知:分金液的主要成分为[AuCl4]—;分金渣的主要成分为AgCl;分银液中主要成分为Ag(SO3)2]3—,且存在[Ag(SO3)2]3—![]() Ag++2SO32—
Ag++2SO32—
(1)“分铜”时,单质铜发生反应的化学方程式为_______________________。已知“分铜”时各元素的浸出率如下表所示。
Cu | Au | Ag | Ni | |
浸出率% | 85.7 | 0 | 4.5 | 93.5 |
“分铜”时加入足量的NaC1的主要作用为_________________________________。
(2)“分金”时,单质金发生反应的离子方程式为__________________________。
(3)某小组模拟工业上回收分银渣中的银,过程如下:
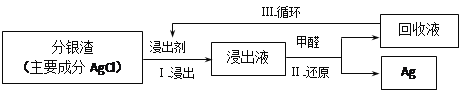
中主要反应:AgCl+2SO32—![]() Ag(SO3)23—+C1—
Ag(SO3)23—+C1—
①研究发现:其他条件不变时,该反应在敞口容器中进行,浸出时间过长会使银的浸出率(浸出液中银的质量占起始分银渣中银的质量的百分比)降低,可能原因是____________________。
②将Ⅱ中反应的离子方程式补充完整:
_____Ag(SO3)23-+_____OH—+_____==_____+_____SO32—+_____+CO32—
③中回收液可直接循环使用,但循环多次后,银的浸出率会降低。从回收液离子浓度变化和反应限度的角度分析原因:________________________________________。
(4)工业上,粗银电解精炼时,电解质溶液的pH为1.5~2,电流为5~10A,若用7A的电流电解60min后,得到21.6gAg,则该电解池的电解效率为________%。(保留小数点后位。通过一定电荷量时阴极上实际沉积的金属质量与理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C·mol—1)
【答案】H202+Cu+2H+=Cu2++2H20 使溶出的Ag+形成AgCl进入分铜渣避免银元素的损失 2Au + 6H++7C1-+C103-=2AuCl4-+3H20 S032-被空气中氧气氧化为S042-,使浸出反应平衡左移,浸出率下降 4 6 HCHO 4Ag 8 4H20 随循环次数的增加,浸出液中C(S032-)减小,C (Cl-)增大,AgCl+2S032-![]() Ag(SO3)23-+Cl-平衡左移,浸出率下降 76.6
Ag(SO3)23-+Cl-平衡左移,浸出率下降 76.6
【解析】
(1)“分铜”时,单质铜被双氧水氧化为Cu2+; C1-与Ag+反应生成AgC1沉淀;
(2)由分金液的主要成分为[AuCl4]—可知,金被NaC103氧化为[AuCl4]—;
(3) ①S032-具有还原性,能被空气中氧气氧化;
②Ag(SO3)23—被甲醛还原为银,根据得失电子守恒、电荷守恒、质量守恒配平方离子程式;
③随循环次数的增加,浸出液中C(S032-)减小,C (Cl-)增大;
(4)根据Q=It计算出电量,可知理论上应沉积的金属质量;
(1)“分铜”时,单质铜被双氧水氧化为Cu2+反应离子方程式是H202+Cu+2H+=Cu2++2H20;C1-与Ag+反应生成AgC1沉淀,加入足量的NaC1使溶出的Ag+形成AgCl进入分铜渣避免银元素的损失;
(2)金被NaC103氧化为[AuCl4]—,反应的离子方程式是2Au + 6H++7C1-+C103-=2AuCl4-+3H20;
(3) ①S032-被空气中氧气氧化为S042-,使浸出反应平衡左移,所以反应在敞口容器中进行,浸出时间过长会使银的浸出率降低;
②Ag(SO3)23—被甲醛还原为银,根据得失电子守恒、电荷守恒、质量守恒配平方离子程式为4Ag(SO3)23-+6OH—+ HCHO ==4Ag +8SO32—+4H20+CO32—;
③随循环次数的增加,浸出液中C(S032-)减小,C (Cl-)增大,AgCl+2S032-![]() Ag(SO3)23-+Cl-平衡左移,浸出率下降;
Ag(SO3)23-+Cl-平衡左移,浸出率下降;
(4) Q=It=7×3600,电子物质的量为7×3600÷96500=0.261mol,所以理论上生成银的质量是0.261mol×108g/mol=28.188g,该电解池的电解效率为21.6g÷28.188g×100%=76.6%。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
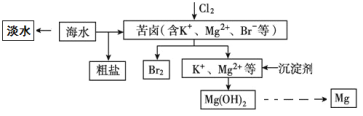
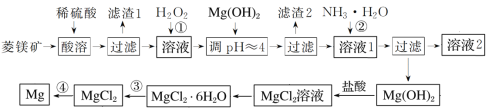
开心蛙口算题卡系列答案【题目】工业上以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备金属镁的实验流程如下:
已知:一些金属离子转化为氢氧化物沉淀时溶液的pH如表所示
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
完全沉淀时 | 3.7 | 5.2 | 9.7 |
请回答:
(1)如果没有过程①,后果是:__________________________________。
(2)上述流程中被循环使用的物质是:____________。
(3)滤渣2的主要成分为:____________;溶液2中的主要溶质为:_____________。
(4)通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,为保证Mg2+沉淀完全,过程②中控制溶液的pH至少为________。(保留小数点后一位)(已知Mg(OH)2的Ksp=2×10-11,lg2=0.3)
(5)已知MgCl2·6H2O受热时发生水解:MgCl2·6H2O=Mg(OH)Cl+HCl↑+5H2O,过程③应该如何操作才能得到无水MgCl2?:_______________________________________________。
(6)写出过程④中发生反应的化学方程式:_____________________________________。
(7)为测定菱镁矿中铁的含量。称取12.5 g菱镁矿样品溶于过量的稀硫酸并完全转移到锥形瓶中,用0.010 mol·L—1H2O2溶液进行滴定。平行测定4组,消耗H2O2溶液的体积数据记录如下表所示。
实验编号 | 1 | 2 | 3 | 4 | 平均值 |
消耗H2O2溶液的体积/mL | 15.00 | 15.02 | 15.62 | 14.98 |
①根据表中数据,可计算出菱铁矿中铁的质量分数为__________%。(保留两位小数)
②H2O2溶液应装在__________ 滴定管中(填“酸式”或“碱式”)
③误差
a.其它操作均正常,滴定终点时仰视读数会导致所测结果_________。
b.滴定之前没有排除滴定中的气泡会导致所测结果_________。