题目内容
(共15分) 某矿样含有大量的CuS及少量其它不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O晶体,流程如下: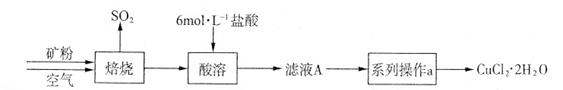
(1)在实验室中,欲用37%(密度为1.19 g·mL-1)的盐酸配制500 mL 6 mol·L-1的盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还有_______________ 、 _______________ 。
(2)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是_______ (填下列各项中序号)。
②CuCl2溶液中存在如下平衡:Cu(H2O)42+(蓝色)+4Cl-  CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。
欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是____ (填下列各项中序号)。 a.FeCl3固体 b.CuCl2固体 c.蒸馏水
(3)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气条件下焙烧CuS时,固体质量变化曲线及SO2生成曲线如下图所示。
①CuS矿样在焙烧过程中,有Cu2S、CuO·CuSO4、CuSO4、CuO生成,转化顺序为下列四阶段:
第①步转化主要在200~300oC范围内进行,该步转化的化学方程式为 _______________ 。
②300~400oC范围内,固体质量明显增加的原因是_______________,上图所示过程中,CuSO4固体能稳定存在的阶段是__________(填下列各项中序号)。
a.一阶段 b、二阶段 c、三阶段 d、四阶段
③该化学小组设计如下装置模拟CuS矿样在氧气中焙烧第四阶段的过程,并验证所得气体为SO2和O2的混合物。
a.装置组装完成后,应立即进行气密性检查,请写出检查A-D装置气密性的操作 __________ 。
b.当D装置中产生白色沉淀时,便能说明第四阶段所得气体为SO2和O2的混合物。你认为装置D中原来盛有的溶液为_______________ 溶液。
c.若原CuS矿样的质量为l0.0 g(含加热不反应的杂质),在实验过程中,保持温度在760oC左右持续加热,待矿样充分反应后,石英玻璃管内所得固体的质量为8.4 g,则原矿样中CuS的质量分数为__________。
(共15分) (1)胶头滴管 500ml容量瓶(各1分)
(2)cd (1分) c(2分)
(3) 2CuS+O2  Cu2S+SO2 (2分)
Cu2S+SO2 (2分)
Cu2S转化为CuSO4固体质量增加(2分) c(1分)
关闭分液漏斗活塞,在D中加水至淹没下端管口,微热A中圆底烧瓶看到D中有气泡冒出,停止微热后导管中有一小段水柱回流,则气密性好(2分)
BaCl2或其他合理答案(1分)
96.0﹪(2分)
解析试题分析:(1)用液体配制溶液,需要量筒、烧杯、玻璃棒、胶头滴管、及容量瓶,本题中需配制500mL的溶液所以需要500mL的容量瓶;
(2)①从滤液到晶体,需要蒸发浓缩、冷却结晶、过滤步骤得到晶体,不需要灼烧、分液,所以答案选cd;
②欲用实验证明滤液A(绿色)中存在上述平衡,则需要改变条件,看是否有平衡移动,因此实验中加入水后溶液蓝色加深,即可证明存在平衡;不能加入氯化铁固体或氯化铜固体,原因是铁离子和铁离子本身有颜色,实验c正确;
(3)①200~300oC范围内进行的是第一阶段,所以产物主要是Cu2S,所以化学方程式为
2CuS+O2  Cu2S+SO2 ;
Cu2S+SO2 ;
②300~400oC范围内,进行的是第二阶段,主要产物是CuO·CuSO4,相当于固体中增加了氧元素的质量,所以固体质量明显增加;从图中可以看出,CuSO4固体能稳定存在的阶段是第三阶段,答案选c;
③A-D装置气密性的检查,利用温度升高,气体压强增大的原理检验,具体操作是:关闭分液漏斗活塞,在D中加水至淹没下端管口,微热A中圆底烧瓶看到D中有气泡冒出,停止微热后导管中有一小段水柱回流,则气密性好;证明第四阶段所得气体为SO2和O2的混合物,气体溶于溶液后可得硫酸根离子,所以只需验证硫酸根离子的存在即可,因此应选择氯化钡溶液;石英玻璃管内所得固体为CuO,其质量为8.4 g,物质的量是0.1mol,根据元素守恒,可得CuS的质量是9.6g,所以原矿样中CuS的质量分数为96%。
考点:考查物质制备,仪器的选择,装置气密性的检查,图像分析,质量分数的计算

下列各组气体在常温下能共存且能用向上排空气法收集的是
| A.NO和O2 | B.HCl和NH3 | C.H2和CO | D.SO2和CO2 |
(14分)曾经有一种固氮的方法:1100°C通N2和CaC2反应得到CaCN2 。
已知:CaCN2+3H2O = 2NH3+CaCO3;CaC2+2H2O = C2H2↑+Ca(OH)2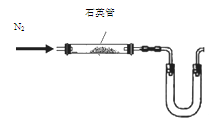
(1)某同学采用以下装置(加热和夹持仪器已略去)制取少量的CaCN2
①U形管中盛放的物质是 (填一种);
② (填“能”或“不能”)用普通玻璃管代替图中石英管;
(2)检验反应后的固体(用W表示)中含有氮元素该同学将适量W溶于水,有气泡产生,说明固体中含有氮元素,该结论不正确。若要得出正确结论,还需进行的实验是 。
(3)测定W中CaCN2的质量分数
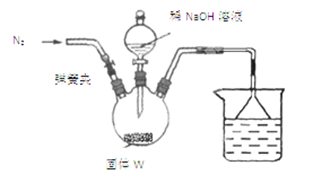
步骤Ⅰ:按如图所示装置(夹持仪器已略去)进行实验:关闭弹簧夹,将漏斗中溶液逐滴加入到三颈瓶中,当W反应完全后,打开弹簧夹,通入氮气,直至氨气被200mL0.1 mol·L-1硫酸完全吸收。
步骤Ⅱ:准确量取烧杯中溶液20.00mL置于锥形瓶中,滴入几滴指示剂,用cmol·L-1NaOH溶液滴定过量的硫酸,实验测得消耗标准溶液的平均体积为vmL。
已知三种常用指示剂变色pH范围如下:
| 指示剂 | a | b | c |
| 变色pH范围 | 3.1~4.4 | 8.0~10.0 | 4.4~6.2 |
| 说明 | pH<3.1显红色 pH>4.4显黄色 | pH<8.0显无色 pH>10.0显红色 | pH<4.4显红色 pH>6.2显黄色 |
②烧杯中最终吸收氨气的物质的量为 mol;经进一步计算可求得W中CaCN2质量分数。
③上述实验所得结果明显偏小,若不考虑装置的气密性和操作误差,则导致结果偏小的可能原因是
(写1种)。
二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 | ||
| S | 112.8 | 444.6 | 略 | ||
| S2Cl2 | -77 | 137 |
|
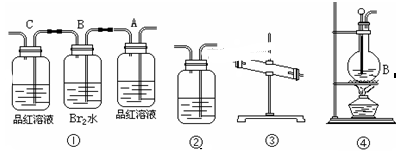
设计实验装置图如下:

(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见 。利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式: 。E中反应的化学方程式: 。
(3)C中的试剂是 。
(4)仪器B的名称是 。F的作用是 。
(5)如果在加热E时温度过高,对实验结果的影响是 。
(6)S2Cl2粗品中可能混有的杂质是(填写两种) ,为了提高S2Cl2的纯度,关键的操作是控制好温度和 。




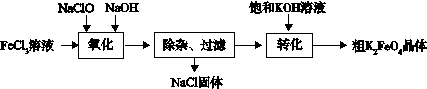
 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH