题目内容
(14分)硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。

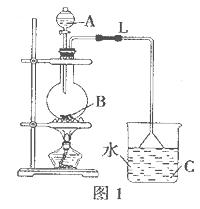
图1 图2
(1)用图1所示装置制取Na2S2O3,其中NaOH溶液的作用是_____________________。
如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有
(填化学式)杂质生成。
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,
该反应的化学方程式为:2Na2S2O3+I2 = 2NaI+Na2S4O6
①利用KIO3、KI和HCl作原料可配制标准碘溶液。写出配制时所发生反应的离子方程式 。
②准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加______作指示剂,用所配制的标准碘溶液滴定。滴定时所用的玻璃仪器除锥形瓶外,还有 。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果___________(填“偏高”“偏低”或“不变”)。
(3)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。
提纯步骤依次为:
①将已称量好的工业级Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待 时,停止加热,将烧瓶取下;
④ __________________________;
⑤ __________________________;
⑥将所得固体洗涤、干燥,即可得到Na2S·9H2O晶体。
(14分)(1)吸收二氧化硫等尾气,防止污染空气 (2分) NaCl(2分)
(2)①IO3-+5I-+6 H+=3I2+ 3H2O(2分)
②淀粉溶液 (2分) 酸式滴定管(2分)
③偏低(1分)
(3)③烧瓶中固体不再减少(1分)
④趁热过滤(1分)
⑤将所得滤液冷却结晶,过滤(1分)
解析试题分析:(1)图1所示装置中有二氧化硫参与反应,所以氢氧化钠的作用是吸收二氧化硫等尾气,防止污染空气;如将分液漏斗中的H2SO4改成浓盐酸,浓盐酸易挥发,与三颈烧瓶内的物质反应生成NaCl,所以三颈烧瓶内除Na2S2O3生成外,还有NaCl杂质生成;
(2)①KIO3、KI和HCl作原料可配制标准碘溶液,说明产物中有单质碘生成,所以化学方程式的元素守恒规律可写出该反应的离子方程式为IO3-+5I-+6 H+=3I2+ 3H2O;
②因为碘遇淀粉变蓝色,所以选择淀粉作指示剂;滴定时Na2S2O3·5H2O样品溶液放于锥形瓶中,则标准碘溶液应放在酸式滴定管中;不能用碱式滴定管盛放碘溶液,因为碘单质有一定的氧化性,容易腐蚀碱式滴定管的胶管部分;
③滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则所用标准碘液偏少,造成Na2S2O3·5H2O的质量分数偏低;
(3)③根据Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精的特点,判断待烧瓶中固体不再减少时停止加热;
④杂质不溶于酒精,所以趁热过滤可除去杂质;
⑤Na2S在低温时在酒精中的溶解度减小,所以将过滤后的滤液冷却结晶,再过滤可得晶体样品。
考点:考查对实验的分析能力,杂质的判断,方程式的书写能力,仪器的选择,实验步骤的判断

锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
I.ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
(1)滤渣1的化学式为 ;②中使用的氧化剂最好是下列的 (填序号)。
| A.Cl2 | B.H2O2 | C.KMnO4 | D.浓HNO3 |
(3)步骤④发生的离子反应方程式为 。
II.BaS溶液的制备

有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s) △H1 = -1473.2 kJ?mol-1
C(s)+ 1/2O2(g)=CO(g) △H2 = -110.5 kJ?mol-1
Ba(s)+ S(s)=BaS(s) △H3 = -460 kJ?mol-1
(4)若煅烧还原的产物仅为BaS和CO,则其反应的热化学方程式为:
。
Ⅲ.制取锌钡白
(5)如果Ⅰ中步骤⑤使用硫酸过量,产生的后果是 。
工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为___________;
②硫酸钠和焦炭、石灰石反应的化学方程式为_________(已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
| | |
| |  |
②装置乙中发生反应的化学方程式为_______;

(3)联合制碱法对氨碱法的改进,其优点是______________;
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?__________。
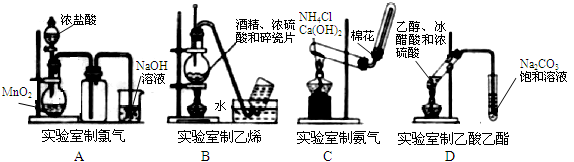


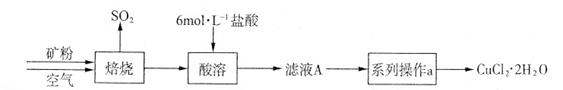

 CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。



 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O