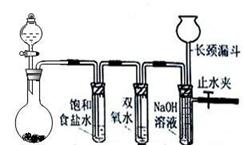
��Ŀ����
��֪�Ҵ����Ժ��Ȼ��Ʒ�Ӧ��������ˮ��CaCl2��6C2H5OH���йص��л��Լ��ķе����£�CH3COOC2H5Ϊ77.1�棻C2H5OHΪ78.3�棻C2H5OC2H5�����ѣ�Ϊ34.5�棻CH3COOHΪ118�档ʵ���Һϳ����������ֲ�Ʒ�IJ������£���������ƿ�ڽ��������Ҵ�������Ũ�����ϣ�Ȼ��Һ©���ߵμӴ��ᣬ���������������ʵ��ɵõ������Ҵ������ѡ������ˮ�����������ֲ�Ʒ��
��1����Ӧ�м�����Ҵ��ǹ����ģ���Ŀ���� ��
��2���ߵμӴ��ᣬ���������Ŀ���� ��
���ֲ�Ʒ�پ����в��辫�ƣ�
��3��Ϊ��ȥ���еĴ��ᣬ�����Ʒ�м��� ������ĸ����
A.��ˮ�Ҵ� B.̼���Ʒ�ĩ C.��ˮ������
��4���������м��뱥���Ȼ�����Һ�������룬��Ŀ���� ��
��5��Ȼ���������м�����ˮ����ͭ������Ŀ���� ��������������������Һ�������һ���������ƿ�ڣ���������ȥ�ͷе���֣��ռ��е���76��~78��֮�����ּ��ô���������������
��1������Ӧ���Ҵ���Ũ�ȣ������ڷ�Ӧ���������������ķ������
��2�����Ӵ���Ũ�ȣ���С����������������Ũ�ȣ�������������Ӧ���������������ķ������
��3��B
��4����ȥ�ֲ�Ʒ�е��Ҵ�
��5����ȥ�ֲ�Ʒ�е�ˮ
���������������1����ȡ���������ķ�Ӧ�ǿ��淴Ӧ������Ӧ���Ҵ���Ũ�ȣ������ڷ�Ӧ���������������ķ�����У�
��2�������������Ҵ������ѵķе�ϵͣ��Ӵ��������Ŀ��ʹ��Ʒ��������С����������Ũ�ȣ�ͬʱ��������Ũ�ȣ�ʹƽ��������У�
��3����������������ˮ��������̼���Ʒ�Ӧ���ɴ����ơ�ˮ��������̼���壬��������ˮ���������²㣬������ˮ�������������ϲ㣬��Һ��ʹ�������룬��˳�ȥ��Ʒ�еĴ��ᣬӦѡ��̼������Һ����ѡB��
��4���ֲ�Ʒ���Ժ����Ҵ������ѡ�ˮ�������Ҵ����Ժ��Ȼ��Ʒ�Ӧ��������ˮ��CaCl2��6C2H5OH�����Լ��뱥�͵��Ȼ�����Һ��Ŀ���dz�ȥ�ֲ�Ʒ�е��Ҵ���
��5����ˮ����ͭ��ˮ���������ɫ��CuSO4��5H2O�����Լ�����ˮ����ͭ������Ŀ���dz�ȥ�ֲ�Ʒ�е�ˮ��Ȼ������ɵ�����������
���㣺����������������ȡʵ�飬�ֲ�Ʒ���ӵ��ж�

����ʵ�鲻�ܴﵽԤ��Ŀ�ĵ���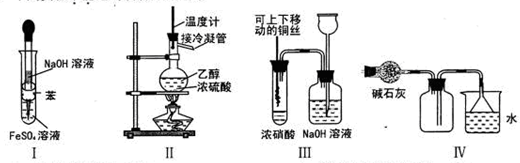
| A������I��ȡFe(OH)2 | B������IIװ����ȡCH2=CH2 |
| C������IIIװ�ý���ͭ��Ũ���ᷴӦ��ʵ�� | D������IVװ���ռ�NH3 |
п������һ�ְ�ɫ���ϡ���ҵ������ZnSO4��BaS��Һ��϶��ɣ�BaS+ZnSO4=ZnS��+BaSO4������������¹�ҵ�������̻ش��й����⡣
I��ZnSO4��Һ���Ʊ����ᴿ��
�й����ϣ�a����п�����Ҫ�ɷ���ZnCO3��������SiO2��FeCO3��Cu2(OH)2CO3�ȣ�b��Zn(OH)2��Al(OH)3���ƣ������ڹ�����NaOH��Һ����Na2ZnO2��
��1������1�Ļ�ѧʽΪ ������ʹ�õ���������������е� ������ţ���
| A��Cl2 | B��H2O2 | C��KMnO4 | D��ŨHNO3 |
��3������ܷ��������ӷ�Ӧ����ʽΪ ��
II��BaS��Һ���Ʊ�

�й����ݣ�Ba��s����S��s����2O2��g����BaSO4��s�� ��H1 = ��1473.2 kJ?mol��1
C��s���� 1/2O2��g����CO��g�� ��H2 = ��110.5 kJ?mol��1
Ba��s���� S��s����BaS��s�� ��H3 = ��460 kJ?mol��1
��4�������ջ�ԭ�IJ����ΪBaS��CO�����䷴Ӧ���Ȼ�ѧ����ʽΪ��
��
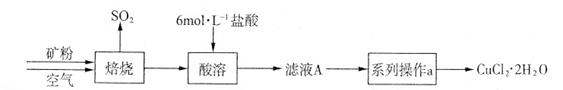
��.��ȡп����
��5��������в����ʹ����������������ĺ���� ��


 CuCl42-(��ɫ)+4H2O��
CuCl42-(��ɫ)+4H2O��