题目内容
二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 | ||
| S | 112.8 | 444.6 | 略 | ||
| S2Cl2 | -77 | 137 |
|
设计实验装置图如下:

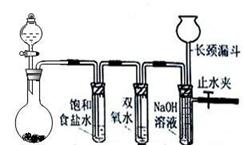
(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见 。利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式: 。E中反应的化学方程式: 。
(3)C中的试剂是 。
(4)仪器B的名称是 。F的作用是 。
(5)如果在加热E时温度过高,对实验结果的影响是 。
(6)S2Cl2粗品中可能混有的杂质是(填写两种) ,为了提高S2Cl2的纯度,关键的操作是控制好温度和 。
(1)用导管将A的上口和B相连(或将A换成恒压滴液漏斗)在G和H之间增加干燥装置
(2)MnO2+4H++2Cl— Mn2++Cl2↑+2H2O 2S+Cl2
Mn2++Cl2↑+2H2O 2S+Cl2 S2Cl2
S2Cl2
(3)饱和食盐水(或水)
(4)蒸馏烧瓶 导气、冷凝
(5)产率降低
(6)SCl2、Cl2、S(任写其中两种即可) 控制浓盐酸的滴速不要过快
解析试题分析:(1)①G收集产品,H中氢氧化钠溶液中水蒸气易挥发,进入G中,易使S2Cl2水解.在G和H之间增加干燥装置.
②若B中气压过大,A中浓盐酸不容易滴下,A与B之间应接一根导管,使A与B内气压相平衡,浓盐酸在重力作用下顺利滴入烧瓶.故答案为:在G和H之间增加干燥装置.
(2)用固液加热的方法制Cl2,常用浓盐酸和二氧化锰反应制取,反应离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O. 2S+Cl2 S2Cl2
S2Cl2
(3)氯气中氯化氢用饱和食盐水吸收,用浓硫酸干燥,先除氯化氢,后干燥.故C中试剂饱和食盐水(或水).
(4)仪器B为蒸馏烧瓶,F导管较长有两个作用:导出产品和冷凝产品.导气、冷凝.
(5)产品热稳定性差,温度过高,产品部分生成了二氯化硫,产率偏低.故答案为:产率降低(或S2Cl2分解)。
(6)由信息可知,可能因温度、水蒸气因素引入HCl,S,SO2,SCl2杂质.若滴加盐酸过快,部分水蒸气没有被硫酸吸收,导入E管中.故应控制浓盐酸的滴速不要过快.
考点:考查实验原理、及学生对装置的理解、评价等相关知识。

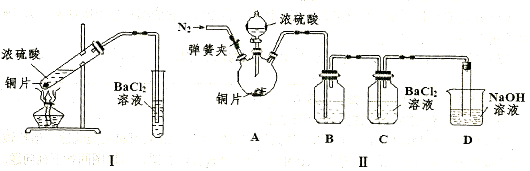
某研究小组在实验室中用铜粉(含铁粉5%以上)制取胆矾(CuSO4·5H2O)并检验其纯度,限选试剂:3 mol·L-1H2SO4溶液、浓硝酸、3%H2O2溶液、0.2 mol·L-1NaOH溶液、20% KSCN溶液、BaCl2溶液。有关物质溶解度如下表(单位g/100 g H2O):
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| CuSO4 | 14.3 | 20.7 | 28.5 | 40.0 | 55.0 | 75.4 |
| Cu(NO3)2 | 81.8 | 124.8 | 163.1 | 181.8 | 207.8 | 247.3 |
(1)完成制取胆矾的实验方案。
| 实验步骤 | 预期现象 |
| 步骤1:除铁。将铜粉置于烧杯中,__________________ | _______________________ |
| 步骤2:溶解。将步骤1得到的铜粉置于烧杯中, __________________________ | _______________________ |
| 步骤3:结晶。将步骤2所得溶液蒸发浓缩至液面有晶膜出现,冷却至室温,过滤得粗产品 | |
(2)完成步骤1后,检验铜粉中的铁是否除尽的实验操作是___________。
(3)若胆矾中含有少量Cu(NO3)2·3H2O,测定其中CuSO4·5H2O的含量,实验步骤如下:称量胆矾样品的质量为m1,加水溶解,滴加足量BaCl2溶液,充分反应后过滤,将滤渣烘干、冷却,称得其质量为m2。样品中CuSO4·5H2O的质量分数为________(列出算式)。
下列根据实验操作和现象得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 某钠盐溶液滴入AgNO3溶液 | 有白色沉淀 | 该钠盐不一定是NaCl |
| B | 浓硫酸与NaCl固体混合加热 | 有气体产生 | 硫酸的酸性比HCl强 |
| C | 某无色气体通入溴水中 | 溴水褪色 | 该气体一定是C2H4 |
| D | 向浓度均为0.1mol·L—1的NaCl和NaI混合溶液中滴加少量的Pb(NO3)2溶液 | 出现黄色沉淀 (PbI2) | KSP(PbI2)<KSP(PbCl2) |
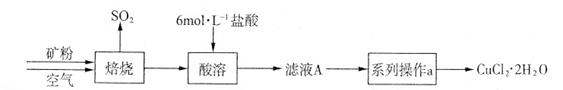

 CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。



 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O