题目内容
7.联合国气候变化框架公约《京都议定书》要求发达国家限制二氧化碳等温室气体排量,以控制日趋严重的温室效应.(1)绿色植物通过光合作用吸收CO2,通过呼吸作用将CO2释放到大气中.
(2)科学家采取“组合转化”技术,将CO2和H2以一定比例混合,在一定条件下反应(反应的化学方程式如下),生成一种重要的化工原料和水.请在括号中填写该化工原料的化学式:2CO2+6H2=1C2H4+4H2O
(3)为了减缓大气中CO2含量的增加,以下建议可行的是①③(填序号)
①开发太阳能、水能、风能、地热等新能源;②禁止使用煤石油、天然气等矿物燃料;③大量植树造林,禁止乱砍滥伐.
分析 (1)根据光合作用和呼吸作用的原理作出解答;
(2)根据质量守恒定律化学反应前后原子的种类和数目都不变确定化学式;
(3)减缓大气中CO2含量的增加的思路一是减小排放、二是增加二氧化碳的消耗.
解答 解:(1)植物光合作用的原理是吸收二氧化碳放出氧气,而呼吸作用的原是吸收氧气放出二氧化碳,故答案为:光合;呼吸;
(2)根据质量守恒定律化学反应前后原子的种类和数目都不变,反应生成的这种化工原料的一个分子中含有两个碳原子和四个氢原子,其化学式为C2H4,
故答案为:C2H4;
(3)了减缓大气中CO2含量的增加的主要方法一是开发利用新的清洁的能源,减少化石能源的利用.二是加大植树造林的力度,提高二氧化碳的吸收能力,
故选①③.
点评 本题考查环境污染及治理,侧重于化学与人体健康的考查,为高考常见题型和高频考点,有利于培养学生的良好科学素养,难度不大,注意相关基础知识的积累.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
1.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1 molCaC2晶体中含有的离子总数为3NA | |
| B. | 常温常压下,3g-CH3中含有的电子数为1.8NA | |
| C. | NA个HCl分子与22.4LH2和Cl2的混合气体所含有的原子数均为2NA | |
| D. | 80 mL 12 mol/L的浓盐酸与足量MnO2反应,生成的Cl2分子数目为0.48 NA |
18.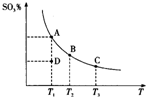 二氧化硫的催化氧化原理为2SO2(g)+O2(g)?2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示.下列说法正确的是( )
二氧化硫的催化氧化原理为2SO2(g)+O2(g)?2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示.下列说法正确的是( )
 二氧化硫的催化氧化原理为2SO2(g)+O2(g)?2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示.下列说法正确的是( )
二氧化硫的催化氧化原理为2SO2(g)+O2(g)?2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示.下列说法正确的是( )| A. | 在D点时,反应逆向进行 | |
| B. | 反应2SO2(g)+O2(g)?2SO3(g)的△H>0 | |
| C. | 若B、C点的平衡常数分别为KB、KC,则KB>KC | |
| D. | 恒温恒压下向平衡体系中通入氦气,平衡向左移动 |
15.对下列化学用语中“2”的含义叙述不正确的是( )
| A. | 2K+中的“2”表示钾离子的个数是2 | |
| B. | 3CO2中“2”表示每个二氧化碳分子中含有2个氧原子 | |
| C. | Cu2+中的“2”表示铜的化合价是+2价 | |
| D. | H2O中的“2”表示一个水分子中含有的氢原子数是2 |
2.某无色气体X可能含有氢气、一氧化碳、二氧化碳和甲烷四种气体中的一种或两种.为确认其组成,某同学取一定量该气体按下图所示装置进行实验(假设每步都充分反应或吸收),结果装置①中无明显变化,装置③增重1.8g,④中增重2.2g.下列关于气体X成分的分析中,错误的是( )
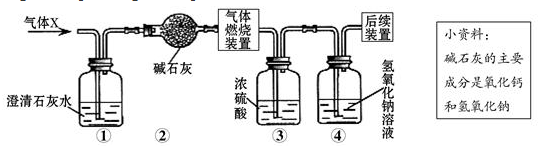

| A. | 一定没有二氧化碳 | B. | 可能含有甲烷和氢气 | ||
| C. | 可能只有甲烷 | D. | 可能含有氢气和一氧化碳 |
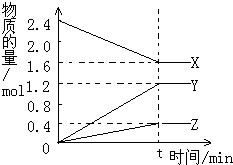 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示: