题目内容
6.已知在溶液中IO3-与I-发生反应5I-+IO3-+6H+═3I2↓+3H2O,根据此反应,可用试纸和一些生活中常见的物质进行实验,证明食盐中存在IO3-.可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤蔗糖,⑥食醋,⑦白酒.进行上述实验时必须使用的物质是( )
| A. | ①③ | B. | ③⑥ | C. | ②④⑥ | D. | ①②④⑤⑦ |
分析 由5I-+IO3-+6H+═3I2↓+3H2O可知,证明食盐中存在IO3-,利用酸性溶液中生成碘单质、淀粉遇碘单质变蓝可检验,以此来解答.
解答 解:证明食盐中存在IO3-,食盐中加碘化钾淀粉试纸、食醋,若试纸变蓝,可证明食盐中存在IO3-,即使用的物质为③⑥,
故选B.
点评 本题考查物质检验实验方案的设计,为高频考点,把握氧化还原反应原理及碘的特性为解答的关键吗,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
14.下列关于浓硝酸和浓硫酸的叙述,正确的是( )
| A. | 常温下都用铜容器贮存 | |
| B. | 露置在空气中,容器内酸液的质量都减轻 | |
| C. | 常温下都能与铜较快反应 | |
| D. | 露置在空气中,容器内酸液的浓度都降低 |
18.反应4A(s)+3B(g)═2C(g)+D(g),经2min,B的浓度减少0.6mol•L-1.对此反应速率的表示,正确的是( )
| A. | 用A表示的反应速率是0.4mol•(L•min)-1 | |
| B. | 在2min末的反应速率,用B表示是0.3mol•(L•min)-1 | |
| C. | 分别用B、C、D表示反应的速率,其比是3:2:1 | |
| D. | 在这2min内用B和C表示的反应速率的值都是逐渐减小的 |
15.有机物A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 | 解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: (1)A的相对分子质量为:90. |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2)A的分子式为:C3H6O3. |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3)用结构简式表示A中含有的官能团: -COOH、-OH. |
(4)A的核磁共振氢谱如下图: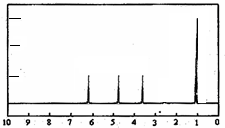 | (4)A中含有4种氢原子. |
(5)综上所述,A的结构简式  . . | |
16.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 无色溶液:Ca2+、H+、Cl-、HSO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| C. | Na2SO4溶液:K+、Fe3+、Cl-、NO3- | |
| D. | $\frac{kW}{c({H}^{+})}$=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3- |
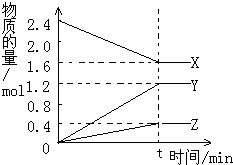 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示: ;B的结构简式为:
;B的结构简式为: .
.