题目内容
9.在检验溶液中SO42-的过程中,下列操作中正确的是( )| A. | 先加入稀硝酸,无沉淀产生,然后再加硝酸钡溶液,产生白色沉淀,证明有SO42-存在 | |
| B. | 先加入硝酸钡溶液,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有SO42-存在 | |
| C. | 先加入稀盐酸,无产生沉淀,然后再加氯化钡溶液,产生白色沉淀,证明有SO42-存在 | |
| D. | 先加入氯化钡溶液,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在 |
分析 SO32-、CO32-也能和Ba2+生成白色沉淀,故在检验SO42-的过程中要注意排除SO32-、CO32- 等离子的影响,据此分析.
解答 解:A、硝酸具有强氧化性,故在溶液中先加入硝酸,会将SO32-氧化为SO42-,导致即使原溶液中无SO42-,再加硝酸钡时也会生成白色沉淀,即此方法不能排除SO32-的
干扰,不能说明原溶液中含SO42-,故A错误;
B、先加硝酸钡,产生白色沉淀,则白色沉淀可能是BaCO3或BaSO3或BaSO4,再加稀硝酸,则BaCO3会溶解,但会将BaSO3氧化为BaSO4,故白色沉淀不溶解,不能说明原溶液中含SO42-,故B错误;
C、先加稀盐酸,会将SO32-、CO32-均反应掉,再加BaCl2,如果还生成白色沉淀,则说明溶液中含SO42-,故C正确;
D、先加BaCl2,如果生成白色沉淀,则白色沉淀可能是BaCO3或BaSO3或BaSO4,还可能是AgCl,再加稀盐酸,BaCO3或BaSO3均溶解,但BaSO4和AgCl均不溶解,故原溶液中可能含SO42-,也可能含Ag+,故D错误.
故选C.
点评 本题比较基础,但要注意排除某些离子的干扰以及应该加入什么试剂才能排除这些离子的干扰.

练习册系列答案
相关题目
20.在①甲烷;②苯;③聚乙烯;④乙醛;⑤2-丁炔;⑥环己烷;⑦邻二甲苯;⑧环己烯这8种物质种中,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
| A. | ③⑤⑧ | B. | ④⑤⑦ | C. | ④⑤⑧ | D. | ③⑥⑦ |
4.25℃、101kPa下,反应2N2O5(g)=4NO2(g)+O2(g)△H=+56.7kJ/mol能自发进行的原因是( )
| A. | 是吸热反应 | B. | 是放热反应 | ||
| C. | 是熵减小的反应 | D. | 熵增效应大于热效应 |
14.下列关于浓硝酸和浓硫酸的叙述,正确的是( )
| A. | 常温下都用铜容器贮存 | |
| B. | 露置在空气中,容器内酸液的质量都减轻 | |
| C. | 常温下都能与铜较快反应 | |
| D. | 露置在空气中,容器内酸液的浓度都降低 |
18.反应4A(s)+3B(g)═2C(g)+D(g),经2min,B的浓度减少0.6mol•L-1.对此反应速率的表示,正确的是( )
| A. | 用A表示的反应速率是0.4mol•(L•min)-1 | |
| B. | 在2min末的反应速率,用B表示是0.3mol•(L•min)-1 | |
| C. | 分别用B、C、D表示反应的速率,其比是3:2:1 | |
| D. | 在这2min内用B和C表示的反应速率的值都是逐渐减小的 |
19.欲除去混在苯中的少量苯酚,下列实验方法正确的是( )
| A. | 直接分液 | |
| B. | 加入氢氧化钠溶液后,充分振荡,静置后分液 | |
| C. | 直接蒸馏 | |
| D. | 加入过量溴水,过滤 |
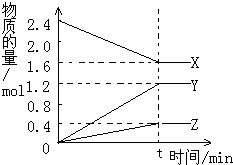 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示: