题目内容
20.工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示: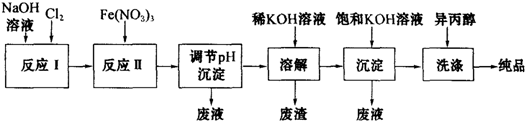
(1)反应Ⅱ的离子方程式为3ClO-+10OH-+2Fe3+═2FeO42-+3Cl-+5H2O;
(2)加入饱和KOH溶液的目的是增大K+的浓度,促进K2FeO4晶体析出;
(3)用异丙醇代替水洗涤产品的好处是减少高铁酸钾的溶解损失.
分析 由流程可知,反应Ⅰ:2NaOH+Cl2═NaCl+NaClO+H2O,加入硝酸铁在碱溶液中发生氧化还原反应,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾,说明高铁酸钠溶解度大于高铁酸钾溶解度,高铁酸钾的溶解度小先析出,再用异丙醇洗涤得到产品;
(1)反应Ⅱ:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;
(2)加入饱和KOH溶液可以增大K+的浓度,使平衡向右移动;
(3)高铁酸钾溶于水,不溶于异丙醇,减少产品的损耗,以此解答该题.
解答 解:由流程可知,反应Ⅰ:2NaOH+Cl2═NaCl+NaClO+H2O,加入硝酸铁在碱溶液中发生3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,可析出高铁酸钾,说明高铁酸钠溶解度大于高铁酸钾溶解度,高铁酸钾的溶解度小先析出,再用异丙醇洗涤得到产品.(1)反应Ⅱ为氧化还原反应,+3价铁被氧化成+6价铁,+1价的氯被氧化为-1价,方程式:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,
故答案为:3ClO-+10OH-+2Fe3+═2FeO42-+3Cl-+5H2O;
(2)Na2FeO4+2KOH?K2FeO4+2NaOH,加入饱和KOH溶液可以增大K+的浓度,使平衡向右移动,析出晶体,故答案为:增大K+的浓度,促进K2FeO4晶体析出;
(3)洗涤粗品时选用异丙醇而不用水的理由是,高铁酸钾易溶于水,难溶于异丙醇,可以减少高铁酸钾的损耗,故答案为:减少高铁酸钾的溶解损失.
点评 本题考查了物质制备方法的分析应用,流程的理解应用,掌握物质性质和平衡移动原理,物质溶解度的大小比较是解题关键,题目难度中等.

| A. | CaCO3(s)═CaO(s)+CO2(g) | B. | NH3(g)+HCl(g)═NH4Cl(s) | ||
| C. | 4Al(s)+3O2(g)═2Al2O3(s) | D. | H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l) |
| A. | 常温常压下,11.2L氯气含有的分之数为0.5NA | |
| B. | 常温常压下,1mol氮气含有的质子数为7NA | |
| C. | 在标准状态下,22.4LH2O含有的原子数目为3NA | |
| D. | 32gO2所含原子数目为2NA |
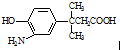 的表述不正确的是( )
的表述不正确的是( )| A. | 该物质能发生缩聚反应 | |
| B. | 该物质有7种不同环境的氢原子 | |
| C. | 该物质遇FeCl3溶液显色,1mol该物质最多能与含1mol Br2的溴水发生取代反应 | |
| D. | 1 mol该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为2:2:1 |
Ⅰ.AgNO3的热稳定性
利用如图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束后,试管中残留固体为黑色Ag.(夹持及加热仪器均省略)
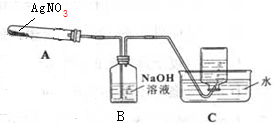
(1)如何检验装置的气密性?连接好仪器后在未加药品之前加热试管,如果C中导气管有气泡冒出,说明气密性良好.
(2)C中集气瓶收集的气体为O2.要收集纯净的该气体,正确的操作是等到导气管中气泡均匀放出时再收集.
(3)AgNO3分解的化学方程式为2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑.
(4)甲同学认为仅凭试管A中的红棕色的气体产生就判定NO2产生是错误的,因为无色NO遇到空气也会变成红棕色,所以加热前应当排尽装置中的空气.你是否同甲的观点?并说明理由否,硝酸银分解生成氧气.
Ⅱ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液的大试管中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,猜测如下:
假设一:Fe被氧化成Fe3+.
假设二:Fe被氧化成Fe2+.
假设三:Fe被氧化成Fe3+或Fe2+.
可选用的试剂:KSCN溶液、酸性KMnO4溶液,氨水,盐酸,硝酸,NaCl溶液
请完成下表:
| 操作 | 现象 | 结论或目的 |
| (1)取少量溶液于试管中,向溶液中加入足量NaCl溶液 | - | 除尽Ag+ |
| (2)取少量上述溶液于试管中加入KSCN溶液,振荡 | 溶液变血红色 | 存在Fe3+ |
| (3)取(1)中少量上述溶液于试管中,加入酸性KMnO4溶液,振荡 | 紫色消失 | 存在Fe2+ |
| A. | 正极为Fe,负极为Zn,电解质Fe2(SO4)3溶液 | |
| B. | 正极为Cu,负极为Fe,电解质FeCl3溶液 | |
| C. | 正极为Cu,负极为Fe,电解质Fe(NO3)3溶液 | |
| D. | 正极为Ag,负极为Fe,电解质Fe2(SO4)3溶液 |
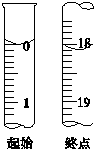 测定产品纯度
测定产品纯度