题目内容
1.某原电池总反应的离子方程式为:2Fe3++Fe=3Fe2+,不能实现该反应的原电池是( )| A. | 正极为Fe,负极为Zn,电解质Fe2(SO4)3溶液 | |
| B. | 正极为Cu,负极为Fe,电解质FeCl3溶液 | |
| C. | 正极为Cu,负极为Fe,电解质Fe(NO3)3溶液 | |
| D. | 正极为Ag,负极为Fe,电解质Fe2(SO4)3溶液 |
分析 原电池总反应离子方程式为:2Fe3++Fe=3Fe2+,Fe失去电子,为原电池的负极,正极为比Fe不活泼的金属或非金属,电解质为氯化铁或硫酸铁,以此来解答.
解答 解:原电池总反应离子方程式为:2Fe3++Fe=3Fe2+,Fe失去电子,为原电池的负极,正极为比Fe不活泼的金属或非金属,电解质为氯化铁或硫酸铁,而A中负极为Zn,该电极上会发生失电子的氧化反应,而不是铁发生失电子的氧化反应,所以A不能实现该反应,符合要求.
故选A.
点评 本题考查原电池,明确电池反应中元素的化合价变化为解答的关键,注意铁离子得电子分析电解质,注重基础知识的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.通常用来衡量一个国家石油化工发展水平的标志是( )
| A. | 石油的产量 | B. | 乙烯的产量 | C. | 硫酸的产量 | D. | 合成纤维的产量 |
16.某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度.有关的叙述正确的是( )
| A. | H2Y的电离方程式为:H2Y+2H2O?2H3O++Y2- | |
| B. | 在该酸式盐溶液中c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) | |
| C. | HY-的水解方程式为HY-+H2O?H3O++Y2- | |
| D. | 在该酸式盐溶液中c(Na+)>c(HY-)>c(OH-)>c(H+) |
6.电子构型为[Ar]3d54s2的元素是( )
| A. | 过渡元素 | B. | 稀有气体 | C. | 主族元素 | D. | 卤族元素 |
13.某元素原子的最外层电子数是次外层电子数的3倍短周期元素,该元素为( )
| A. | 锂 | B. | 铍 | C. | 氧 | D. | 钙 |
10.对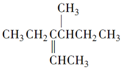 的命名正确的是( )
的命名正确的是( )
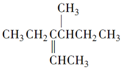 的命名正确的是( )
的命名正确的是( )| A. | 3-异丁基-2-戊烷 | B. | 4-甲基-3-乙基-2-己烯 | ||
| C. | 3-甲基-4-丙烯基己烷 | D. | 2,3-二乙基-3-戊烯 |
11.W、X、Y、Z为原子序数依次增大的同周期的短周期元素.已知W、Y、Z三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水.下列判断正确的是( )
| A. | W、Y、Z三种元素的最高价氧化物的水化物可能有两种是强碱、一种是强酸 | |
| B. | Z元素在第3周期第ⅥA族 | |
| C. | W、Y、Z三种元素有两种是金属、一种是非金属 | |
| D. | W、X、Y三种元素最高价氧化物对应水化物的碱性依次增强 |
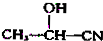 $→_{H_{2}O}^{HCl}$
$→_{H_{2}O}^{HCl}$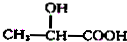
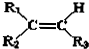 $→_{②Zn/H_{2}O}^{①O}$
$→_{②Zn/H_{2}O}^{①O}$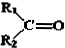 +
+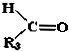
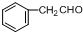 .现有如下转化关系:
.现有如下转化关系: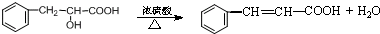 ;反应类型为消去反应;
;反应类型为消去反应;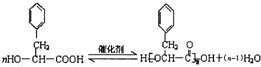 ;
;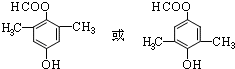 .
.