题目内容
14.NA为阿伏加德罗常数,下列说法正确的是( )| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 1mol甲基(-CH3)所含的电子总数为7NA | |
| D. | 现有乙烯.丙烯.丁烯的混合气体共14g,其原子数为3NA |
分析 A、标况下,戊烷为液态;
B、求出乙烯的物质的量,然后根据1mol乙烯含6mol共用电子对来分析;
C、甲基不显电性;
D、根据乙烯、丙烯和丁烯的最简式均为CH2来分析.
解答 解:A、标况下,戊烷为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、28g乙烯的物质的量为1mol,而1mol乙烯含6mol共用电子对,故B错误;
C、甲基不显电性,故1mol甲基含9mol电子,故C错误;
D、乙烯、丙烯和丁烯的最简式均为CH2,故14g混合气体中含有的CH2的物质的量n=$\frac{14g}{14g/mol}$=1mol,故含有3mol原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.偏二甲肼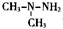 是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )
是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )
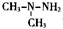 是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )
是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
2.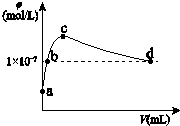 常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )
常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )
 常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )
常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol/L | |
| B. | b点溶液中:c(H+)=1×10-7mol/L | |
| C. | c点溶液中:c(Na+)>c(CO32-)>c(HCO3-) | |
| D. | d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-) |
9.X、Y、Z、R分别代表四种元素,若aXm+、bYn+、cZn-、dRm-四种离子的核外电子排布相同,且m>n,则下列关系正确的是( )
| A. | a-c=m-n | B. | b+d=m+n | C. | a>b>d>c | D. | a>b>c>d |
6.下列分子中所有原子一定处于同一平面的是( )
| A. | CH3CH2CH=CH2 | B. | CH2=CH-CH=CH2 | C. | C6H5-C≡CH | D. | CH3CH=CH2 |
3.某气态烃0.5mol能与1mol HCl完全加成,加成后产物分子中的氢原子又可被3mol Cl2完全取代,则此气态烃可能是( )
| A. | CH3C≡CCH3 | B. | CH2=CH2 | C. | CH≡CCH3 | D. | CH2=CHCH3 |
4.元素周期表里金属元素和非金属元素分界线附近能找到( )
| A. | 新制农药元素 | B. | 制催化剂元素 | ||
| C. | 制半导体元素 | D. | 制耐高温合金元素 |
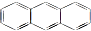 与苯炔(
与苯炔(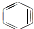 )反应生成化合物X(立体对称图形),如图所示:
)反应生成化合物X(立体对称图形),如图所示: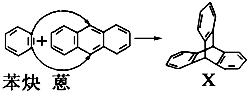
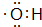 ;
; 的系统命名为3-甲基戊烷.
的系统命名为3-甲基戊烷. .
.