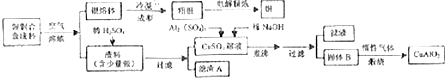
题目内容
19.A、B、C、D、E、F六种短周期元素,且原子序数逐渐增大.已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应.D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个.回答下列问题:(1)写出D的元素名称硅,D的气态氢化物的化学式SiH4E的最高价氧化物的水化物的化学式H3PO4.
(2)画出B元素的离子结构示意图
 .
.(3)若构成F元素的一种核素的中子数为18,写出该核素的符号3517Cl.
(4)C与F元素最高价氧化物的水化物反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(5)将A、C、F的简单离子按照半径由大到小的顺序排列Cl->Na+>Al3+(用离子符号表示)
分析 A、B、C、D、E、F六种短周期元素,且原子序数逐渐增大.A、C、F三种元素的最高价氧化物的水化物之间两两皆能反应,应是氢氧化铝、强碱、强酸之间的反应,且A、C、F三种原子的最外层共有11个电子,可推知A为Na、C为Al、F为Cl;B的原子序数介于Na、Al之间,故B为Mg;D元素原子的最外层电子数比次外层电子数少4个,最外层电子数为4,则D为Si;E元素原子的次外层电子数比最外层电子数多3个,最外层电子数为8-3=5,故E为P元素,据此解答.
解答 解:A、B、C、D、E、F六种短周期元素,且原子序数逐渐增大.A、C、F三种元素的最高价氧化物的水化物之间两两皆能反应,应是氢氧化铝、强碱、强酸之间的反应,且A、C、F三种原子的最外层共有11个电子,可推知A为Na、C为Al、F为Cl;B的原子序数介于Na、Al之间,故B为Mg;D元素原子的最外层电子数比次外层电子数少4个,最外层电子数为4,则D为Si;E元素原子的次外层电子数比最外层电子数多3个,最外层电子数为8-3=5,故E为P元素.
(1)由上述分析可知,D为硅元素,其气态氢化物的化学式SiH4;E为P元素,的最高价氧化物的水化物的化学式为H3PO4,故答案为:硅;SiH4;H3PO4;
(2)B元素的离子为Mg2+,离子结构示意图为: ,故答案为:
,故答案为: ;
;
(3)若Cl元素的一种核素的中子数为18,其质量数为17+18=35,该核素的符号表示为3517Cl,故答案为:3517Cl;
(4)C与F元素最高价氧化物的水化物分别为Al(OH)3、HClO4,二者反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
(5)将A、C、F的简单离子分别为Na+、Al3+、Cl-,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:Cl->Na+>Al3+,故答案为:Cl->Na+>Al3+.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,有利于基础知识的巩固.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | a-c=m-n | B. | b+d=m+n | C. | a>b>d>c | D. | a>b>c>d |
| A. | A、B、C、D | B. | B、A、C、D | C. | D、A、B、C | D. | B、A、D、C |
| A. | 将pH=a的醋酸稀释变为pH=a+1,醋酸的浓度则变为原来的$\frac{1}{10}$ | |
| B. | 将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$变小 | |
| C. | pH=a的醋酸与pH=a+1的醋酸分别中和等物质的量的NaOH溶液,二者所消耗体积比为1:10 | |
| D. | 等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,存在a+b=14 |
| A. | 41 | B. | 115 | C. | 142 | D. | 162 |
| A. | 新制农药元素 | B. | 制催化剂元素 | ||
| C. | 制半导体元素 | D. | 制耐高温合金元素 |
| A. | 熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH=Na2SiO3+H2O | |
| B. | 甲醇燃料电池(KOH作电解质溶液)的负极反应式:CH3OH-6e+H2O=CO2+6H+ | |
| C. | 红热的铁丝与水接触,表面形成黑色保护层:3Fe+4H2O=Fe3O4+4H2 | |
| D. | “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO-+Cl-+2H+=Cl2↑+H2O |
| A. | 加锌盐 | B. | 加碘盐 | C. | 加钙盐 |