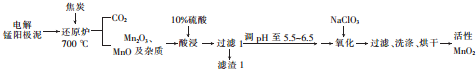
题目内容
13.已知反应①:
化合物Ⅱ可由化合物Ⅰ制备,路线如下;
Ⅰ$\stackrel{Br_{2}}{→}$Ⅳ→V$→_{CrO_{3}}^{氧化}$Ⅱ$→_{ii、H+}^{i、足量新制Cu(OH)_{2}△}$Ⅵ
(1)化合物Ⅲ的化学式为C8H10O2,l mol化合物Ⅲ最多能与3mol H2发生加成反应.
(2)写出转化Ⅳ→V的化学方程式BrCH2CH=CHCH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH=CHCH2OH+2NaBr(注明条件).
(3)化合物Ⅲ有多种同分异构体,其中符合下列条件的异构体有6种,写出其中任意一种的结构简式:
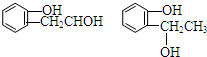 等.①遇FeCl3溶液显紫色; ②在浓硫酸催化作用下能发生消去反应.
等.①遇FeCl3溶液显紫色; ②在浓硫酸催化作用下能发生消去反应.(4)化合物V和化合物Ⅵ在一定条件下按物质的量m:n反应合成高分子化台物Ⅶ,且原子转化率为100%.高分子化合物Ⅶ的结构简式为
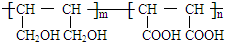 .
.(5)
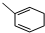 能与CH2=CHCOOH发生类似反应①的反应,生成化合物Ⅷ,写出Ⅷ的一种结构简式为
能与CH2=CHCOOH发生类似反应①的反应,生成化合物Ⅷ,写出Ⅷ的一种结构简式为 .
.
分析 Ⅰ与溴水发生1,4-加成所生产的Ⅳ为CH2BrCH=CHCH2Br,Ⅳ在氢氧化钠水溶液、加热条件下发生水解反应生成Ⅴ为HOCH2CH=CHCH2OH,V发生氧化反应生成Ⅱ,化合物Ⅱ与新制氢氧化铜溶液、酸化得到Ⅵ,则醛基转化为羧基,则Ⅵ为HOOCCH=CHCOOH;
(3)化合物Ⅲ对应的同分异构体反应:①遇FeCl3溶液显紫色,说明含有酚羟基;②在浓硫酸催化作用下能发生消去反应,含有醇羟基,较好Ⅲ的结构可知,侧链为-OH、-CH2CH2OH,或-OH、-CH(CH3)OH,各
有邻、间、对三种;
(4)化合物Ⅴ和化合物Ⅵ在一定条件下按物质的量m:n反应合成高分子化合物Ⅶ,且原子转化率为100%,说明发生加聚反应;
(5) 能与CH2=CHCOOH发生类似反应①的反应,碳碳双键均断裂,
能与CH2=CHCOOH发生类似反应①的反应,碳碳双键均断裂, 的中间碳原子之间形成1个新的碳碳双键,另外2个碳原子与CH2=CHCOOH中不饱和碳原子连接,有2种不同连接方式.
的中间碳原子之间形成1个新的碳碳双键,另外2个碳原子与CH2=CHCOOH中不饱和碳原子连接,有2种不同连接方式.
解答 解:Ⅰ与溴水发生1,4-加成所生产的Ⅳ为CH2BrCH=CHCH2Br,Ⅳ在氢氧化钠水溶液、加热条件下发生水解反应生成Ⅴ为HOCH2CH=CHCH2OH,V发生氧化反应生成Ⅱ,化合物Ⅱ与新制氢氧化铜溶液、酸化得到Ⅵ,则醛基转化为羧基,则Ⅵ为HOOCCH=CHCOOH.
(1)由结构简式可知化合物Ⅲ的化学式为C8H10O2,碳碳双键与醛基均氢气发生加成反应,故l mol化合物Ⅲ最多能与3mol H2发生加成反应,
故答案为:C8H10O2;3;
(2))Ⅳ→Ⅴ是卤代烃在氢氧化钠水溶液、加热条件下发生的水解反应,反应方程式为:BrCH2CH=CHCH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH=CHCH2OH+2NaBr,
故答案为:BrCH2CH=CHCH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH=CHCH2OH+2NaBr;
(3)化合物Ⅲ对应的同分异构体反应:①遇FeCl3溶液显紫色,说明含有酚羟基;②在浓硫酸催化作用下能发生消去反应,含有醇羟基,较好Ⅲ的结构可知,侧链为-OH、-CH2CH2OH,或-OH、-CH(CH3)OH,各
有邻、间、对三种,共有6种,其中任意一种为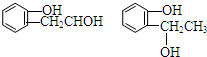 等,
等,
故答案为:6;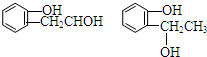 等;
等;
(4)化合物Ⅴ和化合物Ⅵ在一定条件下按物质的量m:n反应合成高分子化合物Ⅶ,且原子转化率为100%,说明发生加聚反应,生成物结构简式为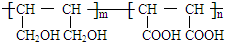 ,
,
故答案为: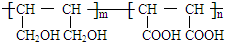 ;
;
(5) 能与CH2=CHCOOH发生类似反应①的反应,碳碳双键均断裂,
能与CH2=CHCOOH发生类似反应①的反应,碳碳双键均断裂, 的中间碳原子之间形成1个新的碳碳双键,另外2个碳原子与CH2=CHCOOH中不饱和碳原子连接,有2种不同连接方式Ⅷ的一种结构简式为:
的中间碳原子之间形成1个新的碳碳双键,另外2个碳原子与CH2=CHCOOH中不饱和碳原子连接,有2种不同连接方式Ⅷ的一种结构简式为: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成、官能团结构与性质、同分异构体书写等,需要学生熟练掌握官能团的结构、性质以及相互转化,较好的考查学生自学能力、知识迁移运用能力,难度中等.

 阅读快车系列答案
阅读快车系列答案
①按上图连接好装置,检查装置气密性.
②称取适量 Fe2O3于石英试管中,点燃Ⅰ处酒精灯,缓慢滴入甲酸.
③在完成某项操作后,点燃另外两处酒精灯.
④30min后熄灭酒精灯,关闭弹簧夹.
⑤待产物冷却至室温后,收集产物.
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物.
请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下的分解制得,盛放甲酸的仪器名称为分液漏斗,该反应的化学方程式HCOOH $→_{△}^{浓硫酸}$CO↑+H2O.
(2)实验步骤③某项操作是指检验CO纯度.
(3)实验步骤④熄灭酒精灯的顺序为Ⅲ、I、II.(填Ⅰ,Ⅱ,Ⅲ)
(4)通过查资料获取如下信息:
Ⅰ.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃.
Ⅱ.资料指出当反应温度高于710℃,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4.试分析酒精灯加热条件下生成Fe的原因是长时间集中加热使局部温度达到还原生成铁所需要的温度.
(5)已知FeO、Fe2O3、Fe3O4氧元素的质量分数分别为:22.2%、30%、27.6%.
利用仪器分析测出3种样品所含元素种类和各元素的质量分数如下表:
| 加热方式 | 产物元素组成 | 各元素的质量分数% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
(6)通过进一步的仪器分析测出前二种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe.请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为12:1.(要求保留整数)
| A. | pH=1的溶液中:K+、Cr2O72-、C6H5OH、CO32- | |
| B. | c(H+)=1×10-13mol/L的溶液中:Cu2+、Na+、Cl-、SO42- | |
| C. | 0.1 mol/L NH4HCO3溶液中:K+、Na+、Cl-、NO3- | |
| D. | 0.1 mol/L Na2SiO3溶液中:K+、Cl-、NO3-、CO2 |
【提出假设】
假设1:沉淀为Cu (OH)2
假设2:沉淀为CuCO3
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3•mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水).
【定性探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:甲同学取一定量固体,用气密性良好的如下装置(夹持仪器未画出)进行定性实验;
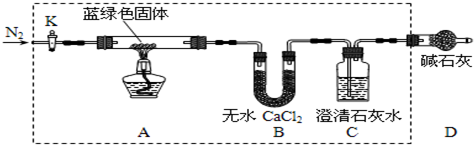
(1)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设1成立.
(2)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,便可验证上述所有假设,该试剂是B(填代号).
A.浓硫酸 B.无水CuSO4 C.碱石灰 D.P2O5
(3)乙同学验证假设3成立的实验现象是A中蓝绿色固体变黑色,B中无水CuSO4固体变蓝,C中有白色沉淀产生.
【定量探究】
(4)乙同学进一步探究假设3中固体的组成:
①乙同学查得一些物质在20℃的数据(如表)后,将C中的澄清石灰水改为Ba(OH)2溶液,其原因是AC(填代号)
| 溶解度(S)/g | 溶度积(Ksp) | 摩尔质量(M)/g•mol-1 | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
B.Ba(OH)2为强碱,Ca(OH)2为弱碱
C.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
D.相同条件下,CaCO3的溶解度明显大于BaCO3
②若所取蓝绿色固体质量为54.2g,实验结束后装置B的质量增加5.4g,C中的产生沉淀的质量为39.4g.则该蓝绿色固体的化学式为2CuCO3•3Cu(OH)2;A中发生的反应的化学方程式为2CuCO3•3Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$5CuO+3H2O↑+2CO2↑.

| A. | 化合物M的分子式为C14H15NO7 | |
| B. | 化合物M能使酸性KMnO4溶液褪色 | |
| C. | 化合物M能发生加成反应,不能发生消去反应 | |
| D. | 1mol在NaOH溶液中反应,最多消耗4molNaOH |