题目内容
5.甲烷与氢气的混合气体,其密度是氢气的5倍(相同条件),则混合气体中甲烷与氢气的体积比为4:3.分析 相同条件下,气体的摩尔质量与密度呈正比,据此计算混合气体平均摩尔质量,然后设出甲烷和氢气的体积,根据平均摩尔质量列式计算.
解答 解:甲烷与氢气的混合气体,其密度是氢气的5倍(相同条件),
则混合气体的平均摩尔质量为:2g/mol×5=10g/mol,
设甲烷的体积为x、氢气的体积为y,相同条件下气体体积与物质的量成正比,
根据平均摩尔质量可得:$\frac{16x+2y}{x+y}$=10,整理可得x:y=4:3,
故答案为:4:3.
点评 本题考查混合物有关的计算,难度不大,可以利用十字交叉法进行计算,有利于学生的化学计算能力的培养.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
15.用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 28g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA |
16.下列说法中正确的是( )
| A. | 一束光线分别通过溶液和胶体时,后者能看到一条光亮的“通路”,前者则没有 | |
| B. | 蔗糖、硫酸钡和氨气分别属于非电解质、强电解质和弱电解质 | |
| C. | Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| D. | 沼气、天然气和水煤气分别属于化石能源、可再生能源和二次能源 |
20.化学与生活息息相关.下列说法正确的是( )
| A. | 纳米碳酸钙材料能够产生丁达尔效应 | |
| B. | NOx、SO2、PM2.5颗粒都会导致酸雨 | |
| C. | 纯碱可用于制造玻璃,也可用于除去物品表面的油污 | |
| D. | 糖类、油脂、蛋白质均能发生水解反应 |
10.对下列电解质溶液的叙述错误的是( )
| A. | 等物质的量浓度的Na2CO3和NaHCO3混合液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| B. | 25℃时 0.2 mol•L-1盐酸与等体积0.05 mol.L-1Ba(OH)2溶液混合后,溶液的pH=l | |
| C. | 25℃时,pH=3的二元弱酸H2R溶液与pH=ll的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+) | |
| D. | 25℃时,若0.3 mol.L-1 HY溶液与0.3 mol.L-lNaOH溶液等体积混合后,溶液的pH=9,则:c(OH-)-c(HY)=1×lO-9 mol.L-1 |
17.某个有机化合物分子式为C4H8O2,其PMR谱中有4个信号且强度之比为3:2:2:1,该有机化合物的结构简式可写( )
| A. | 2种 | B. | 3种 | C. | 5种 | D. | 6种 |
14.关于下列各实验装置图的叙述中,不正确的是( )
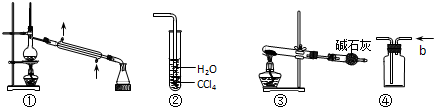

| A. | 装置①常用于分离某些互溶的液体混合物 | |
| B. | 装置②可用于吸收HCl气体,并防止倒吸 | |
| C. | 以NH4HCO3为原料,装置③可用于实验室制备少量NH3 | |
| D. | 装置④b口进气,可用排空气法收集H2、NO等气体 |
20.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1NaHC2O4溶液与0.1mol•L-1KOH溶液等体积混合,所得溶液中:c(Na+)>c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-) | |
| B. | 20mL 0.1 mol•L-1 NH4Cl溶液与10mL 0.1mol•L-1NaOH溶液混合后溶液呈碱性,所得溶液中:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) | |
| C. | 常温下,pH=2的HF溶液与pH=12的氢氧化钠溶液等体积混合,所得溶液中:c(Na+)+c(OH-)>c(H+)+c(F-) | |
| D. | 0.1mol•L-1 NH3•H2O溶液与0.1mol•L-1HNO3等体积混合,所得溶液中:c(H+)>c(OH-)+c(NH3•H2O) |
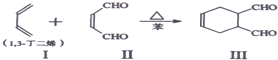
 等.①遇FeCl3溶液显紫色; ②在浓硫酸催化作用下能发生消去反应.
等.①遇FeCl3溶液显紫色; ②在浓硫酸催化作用下能发生消去反应.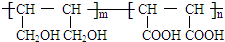 .
.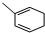 能与CH2=CHCOOH发生类似反应①的反应,生成化合物Ⅷ,写出Ⅷ的一种结构简式为
能与CH2=CHCOOH发生类似反应①的反应,生成化合物Ⅷ,写出Ⅷ的一种结构简式为 .
.