题目内容
1.25℃时,下列分子或离子在指定溶液中一定能大量共存的一组是( )| A. | pH=1的溶液中:K+、Cr2O72-、C6H5OH、CO32- | |
| B. | c(H+)=1×10-13mol/L的溶液中:Cu2+、Na+、Cl-、SO42- | |
| C. | 0.1 mol/L NH4HCO3溶液中:K+、Na+、Cl-、NO3- | |
| D. | 0.1 mol/L Na2SiO3溶液中:K+、Cl-、NO3-、CO2 |
分析 A.pH=1的溶液,显酸性;
B.c(H+)=1×10-13mol/L的溶液,显碱性;
C..1 mol/L NH4HCO3溶液中,该组离子之间不反应;
D.与CO2反应生成硅酸沉淀.
解答 解:A.pH=1的溶液,显酸性,H+、Cr2O72-、C6H5OH发生氧化还原反应,H、CO32-结合生成水和气体,不能共存,故A错误;
B.c(H+)=1×10-13mol/L的溶液,显碱性,Cu2+、OH-结合生成沉淀,不能共存,故B错误;
C..1 mol/L NH4HCO3溶液中,该组离子之间不反应,可大量共存,故C正确;
D.Na2SiO3溶液与CO2反应生成硅酸沉淀,不能大量共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
20.给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4$→_{高温}^{H_{2}}$Si | |
| B. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg | |
| C. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$[Ag(NH3)2]OH(aq)$→_{△}^{蔗糖}$Ag |
9.中学化学教材中有大量数据,下列为某同学利用教材中的数据所做的判断,其中不正确的是( )
| A. | 用溶解度数据,可判断煮沸Mg(HCO3)2溶液所得产物是Mg(OH)2还是MgCO3 | |
| B. | 用沸点数据,可推测能否将一些液体混合物用分馏的方法分离开来的可能性 | |
| C. | 用反应热数据的大小,可判断不同反应的反应速率的快慢 | |
| D. | 用原子半径数据,可推断某些原子氧化性或还原性的强弱 |
16.下列说法中正确的是( )
| A. | 一束光线分别通过溶液和胶体时,后者能看到一条光亮的“通路”,前者则没有 | |
| B. | 蔗糖、硫酸钡和氨气分别属于非电解质、强电解质和弱电解质 | |
| C. | Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| D. | 沼气、天然气和水煤气分别属于化石能源、可再生能源和二次能源 |
10.对下列电解质溶液的叙述错误的是( )
| A. | 等物质的量浓度的Na2CO3和NaHCO3混合液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| B. | 25℃时 0.2 mol•L-1盐酸与等体积0.05 mol.L-1Ba(OH)2溶液混合后,溶液的pH=l | |
| C. | 25℃时,pH=3的二元弱酸H2R溶液与pH=ll的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+) | |
| D. | 25℃时,若0.3 mol.L-1 HY溶液与0.3 mol.L-lNaOH溶液等体积混合后,溶液的pH=9,则:c(OH-)-c(HY)=1×lO-9 mol.L-1 |
11.下列设计的实验方案能达到实验目的是( )
| A. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和Na2CO3溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe2+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
 物质结构决定物质性质.回答下列问题:
物质结构决定物质性质.回答下列问题: ,其中心原子N的杂化方式是sp3.
,其中心原子N的杂化方式是sp3.


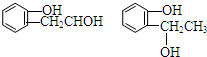 等.①遇FeCl3溶液显紫色; ②在浓硫酸催化作用下能发生消去反应.
等.①遇FeCl3溶液显紫色; ②在浓硫酸催化作用下能发生消去反应.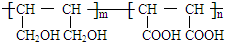 .
.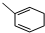 能与CH2=CHCOOH发生类似反应①的反应,生成化合物Ⅷ,写出Ⅷ的一种结构简式为
能与CH2=CHCOOH发生类似反应①的反应,生成化合物Ⅷ,写出Ⅷ的一种结构简式为 .
.