题目内容
2.一定条件下,对于密闭容器中进行的可逆反应 N2+3H2?2NH3,已知反应达到平衡时N2 、H2、NH3的物质的量浓度分别为0.2mol•L-1 、0.3mol•L-1 、0.2mol•L-1 ,则N2 的起始浓度范围可能是多少?分析 N2+3H2?2NH3为可逆反应,既可以从正反应开始,也可以从逆反应开始,不论从哪个方向开始,物质都不能完全反应,N2和H2的化学计量数为1:3,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值.
解答 解:若反应向正反应进行到达平衡,假定完全反应,NH3的平衡时物质的量浓度为0.2mol•L-1 ,由方程式N2+3H2?2NH3可知消耗0.1mol•L-1 N2,
则N2 的起始浓度为0.3mol/L,
若反应逆正反应进行到达平衡,假定完全反应,H2的平衡时物质的量浓度为0.3mol•L-1 ,则由方程式N2+3H2?2NH3可知生成0.1mol/L的氮气,而平衡时氮气的浓度为0.2moL/L,则起始时为0.1mol/L,
由于为可逆反应,物质不能完全转化,所以起始时浓度范围为0.1<c(N2)<0.3,
答:N2 的起始浓度范围可能是0.1<c(N2)<0.3.
点评 本题考查了可逆反应的特点,题目难度不大,转移明确可逆反应中反应物转化率不可能为100%,该题是高考中的常见题型,注重基础,侧重考查学生分析问题、解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.对下列电解质溶液的叙述错误的是( )
| A. | 等物质的量浓度的Na2CO3和NaHCO3混合液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| B. | 25℃时 0.2 mol•L-1盐酸与等体积0.05 mol.L-1Ba(OH)2溶液混合后,溶液的pH=l | |
| C. | 25℃时,pH=3的二元弱酸H2R溶液与pH=ll的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+) | |
| D. | 25℃时,若0.3 mol.L-1 HY溶液与0.3 mol.L-lNaOH溶液等体积混合后,溶液的pH=9,则:c(OH-)-c(HY)=1×lO-9 mol.L-1 |
17.某个有机化合物分子式为C4H8O2,其PMR谱中有4个信号且强度之比为3:2:2:1,该有机化合物的结构简式可写( )
| A. | 2种 | B. | 3种 | C. | 5种 | D. | 6种 |
7.瑞典皇家科学院宣布,包括美籍华裔科学家钱永健在内的3名科学家获得2008年度诺贝尔化学奖,帮助他们获奖的是能发出鲜艳绿光的绿色银光蛋白GFP,下列对GFP结构和性质的预测不正确的是( )
| A. | GFP可以溶于水,且其水溶液可以通过滤纸 | |
| B. | 为了防止GFP变质,可以培养在福尔马林溶液中 | |
| C. | GFP在一定条件下会发生水解,且水解产物一定只有α-氨基酸 | |
| D. | 灼烧GFP会产生烧焦羽毛的气味 |
14.关于下列各实验装置图的叙述中,不正确的是( )
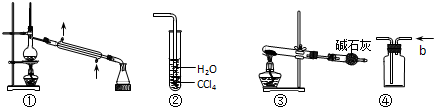

| A. | 装置①常用于分离某些互溶的液体混合物 | |
| B. | 装置②可用于吸收HCl气体,并防止倒吸 | |
| C. | 以NH4HCO3为原料,装置③可用于实验室制备少量NH3 | |
| D. | 装置④b口进气,可用排空气法收集H2、NO等气体 |
11.下列设计的实验方案能达到实验目的是( )
| A. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和Na2CO3溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe2+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
17.下列有关说法正确的是( )
| A. | 白铁(镀锌铁皮)镀层破损后铁仍不易腐蚀 | |
| B. | CH3Cl(g)+Cl2(g)$\stackrel{光照}{→}$CH2Cl2(l)+HCl(g)能自发进行,则该反应的△H>0 | |
| C. | MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)<Ksp(MnS) | |
| D. | 合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率 |
 物质结构决定物质性质.回答下列问题:
物质结构决定物质性质.回答下列问题: ,其中心原子N的杂化方式是sp3.
,其中心原子N的杂化方式是sp3.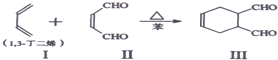
 等.①遇FeCl3溶液显紫色; ②在浓硫酸催化作用下能发生消去反应.
等.①遇FeCl3溶液显紫色; ②在浓硫酸催化作用下能发生消去反应.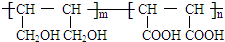 .
.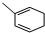 能与CH2=CHCOOH发生类似反应①的反应,生成化合物Ⅷ,写出Ⅷ的一种结构简式为
能与CH2=CHCOOH发生类似反应①的反应,生成化合物Ⅷ,写出Ⅷ的一种结构简式为 .
.