题目内容
9.现有部分短周期元素的性质或原子结构如下表:| 元素编号 | 元素性质或原子结构 |
| A | 室温下其单质呈粉末状黄色固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 最外层电子数比次外层电子数多3个 |
| D | 元素最高正价是+7价 |
| E | 主族元素中得电子能力最强 |
| F | 空气的主要成分之一,其某种同素异形体是保护地球地表环境的重要屏障 |
| G | 第3周期元素的简单离子中半径最小 |
(2)写出元素F的离子结构示意图
 .
.(3)写出G元素最高价氧化物对应的水化物的化学式是Al(OH)3.
(4)元素D与元素A相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与氢氧化钠溶液反应
(5)A、B、C、D四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种酸的是H2CO3,理由是碳酸属于弱酸,其它三种酸均为强酸.
(6)C、E、F、G四种元素的单质中化学性质明显不同于其他三种单质的是Al,理由Al具有金属性或是金属.
(7)F的阴离子和G的阳离子的半径大小比较:F->Al3+(用离子符号表示)
(8)A、D的简单离子的还原性强弱:S2->Cl-(用离子符号表示)
分析 短周期元素中,室温下A单质呈粉末状黄色固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰,则A为S元素;B元素原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;C元素原子最外层电子数比次外层电子数多3个,子只能有2个电子层,最外层电子数为5,故C为N元素;D元素最高正价是+7价,则D为Cl;E是主族元素中得电子能力最强的,则E为氟元素;F元素单质是空气的主要成分之一,其某种同素异形体是保护地球地表环境的重要屏障,则F为O元素;G是第3周期元素的简单离子中半径最小的,则G为Al,据此解答.
解答 解:短周期元素中,室温下A单质呈粉末状黄色固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰,则A为S元素;B元素原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故B为碳元素;C元素原子最外层电子数比次外层电子数多3个,子只能有2个电子层,最外层电子数为5,故C为N元素;D元素最高正价是+7价,则D为Cl;E是主族元素中得电子能力最强的,则E为氟元素;F元素单质是空气的主要成分之一,其某种同素异形体是保护地球地表环境的重要屏障,则F为O元素;G是第3周期元素的简单离子中半径最小的,则G为Al.
(1)A为硫元素,其气态氢化物的化学式是H2S,元素B为碳元素,含8个中子的一种同位素可测定文物年代,这种同位素的符号是 146C,
故答案为:H2S; 146C;
(2)F为O元素,O2-离子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)G为Al元素,最高价氧化物对应的水化物的化学式是Al(OH)3,故答案为:Al(OH)3;
(4)D为Cl元素、A为S元素,同周期自左而右非金属性增强,故非金属性Cl>S;
a.单质状态属于物理性质,不能比较元素非金属性强弱,故错误;
b.元素非金属性越强,氢化物越稳定,故正确;
c.一定条件下氯气和硫的单质都能与氢氧化钠溶液反应,不能比较非金属性强弱,故错误,
故答案为:Cl;b;
(5)A、B、C、D四种元素的最高价氧化物对应的水化物分别为硫酸、碳酸、硝酸、高氯酸,碳酸属于弱酸,其它三种酸均为强酸,
故答案为:H2CO3;碳酸属于弱酸,其它三种酸均为强酸;
(6)C、E、F、G四种元素的单质中,Al具有金属性或是金属,化学性质明显不同于其他三种单质,
故答案为:Al;Al具有金属性或是金属;
(7)F-、Al3+电子层结构相同,核电荷数越大;离子半径越小,故离子半径:F->Al3+,故答案为:F->Al3+;
(8)非金属性S<Cl,阴离子还原性:S2->Cl-,故答案为:S2->Cl-.
点评 本题考查结构性质位置关系综合应用,难度不大,侧重对基础知识的巩固,注意掌握金属性、非金属性强弱比较及实验事实.

 阅读快车系列答案
阅读快车系列答案①离子化合物一定含离子键,也可能含共价键
②共价化合物可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在化学键
⑥熔融状态能导电的化合物一定是离子化合物.
| A. | ①③⑤ | B. | ②④⑥ | C. | ②③④ | D. | ①③⑥ |
| A. | 实验中所用到的滴定管、容量瓶,在使用前均需要检漏 | |
| B. | 如果实验中需用60mL 稀硫酸标准溶液,配制时应选用100ML容量瓶 | |
| C. | 容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小 | |
| D. | 酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大 | |
| E. | 配制溶液时,定容时俯视度数,则导致实验结果偏大 | |
| F. | 中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大 |
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.061 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应难易程度为L<Q | |
| C. | M与T形成的化合物能与氢氧化钠反应 | |
| D. | L2+与R2-的核外电子数相等 |
| A. | 白磷在260℃时转化为红磷 | B. | 石墨在高温下转化为金刚石 | ||
| C. | NaCl熔化 | D. | 氧化钙吸水 |
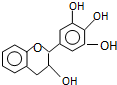 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )| A. | 分子中所有的原子共面 | |
| B. | 1molEGC与4molNaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,难发生加成反应 | |
| D. | 一定条件下的氧化产物能发生银镜反应 |
| A. | 当A、B都是金属,A的还原性一定比B强 | |
| B. | 当A、B都是非金属时,A的非金属性一定比B强 | |
| C. | 当A是金属时,B可能是金属,也可能是非金属 | |
| D. | 当A是非金属时,B可能是非金属,也可能是金属 |
 铜板上鉄柳钉若较长时间地浸泡在海水中会生锈甚至腐烂,其腐蚀远离如图所示,下列有关此过程的说法不正确的是( )
铜板上鉄柳钉若较长时间地浸泡在海水中会生锈甚至腐烂,其腐蚀远离如图所示,下列有关此过程的说法不正确的是( )| A. | 正极上的主要电极反应式:2H2O+O2+4e-→4OH- | |
| B. | 此过程中铜并未被腐蚀 | |
| C. | 电子从Cu流向Fe | |
| D. | 此过程中还可能涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 |