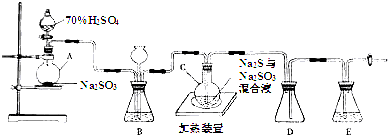
题目内容
19.一定物质的量浓度溶液的配置和酸碱中和滴定是中学化学中两个典型的定量实验.某研究性学习小组在实验室中配置1mol•L-1的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是( )| A. | 实验中所用到的滴定管、容量瓶,在使用前均需要检漏 | |
| B. | 如果实验中需用60mL 稀硫酸标准溶液,配制时应选用100ML容量瓶 | |
| C. | 容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小 | |
| D. | 酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大 | |
| E. | 配制溶液时,定容时俯视度数,则导致实验结果偏大 | |
| F. | 中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大 |
分析 A.根据容量瓶、滴定管的构造及正确使用方法进行分析;
B.实验室没有60mL容量瓶,需要选用100mL容量瓶配制该浓度的溶液;
C.容量瓶中含有少量蒸馏水无影响;
D.滴定管没有润洗,会导致标准液被稀释,滴定时消耗的标准液体积偏大;
E.配制溶液时,定容时俯视度数,溶液体积偏小;
F.中和滴定时,若在最后一次读数时俯视读数,则消耗的标准溶液体积偏大.
解答 解:A.容量瓶有瓶塞,配制时需要摇匀,所以使用前必须检查是否漏水;滴定管有旋塞或者橡胶管,使用前必须检查是否漏液,故A正确;
B.由于实验室中没有60mL容量瓶,所以需要选用100mL容量瓶配制1mol/L的溶液,故B正确;
C.在配制溶液时,要加蒸馏水定容,所以容量瓶中含有少量蒸馏水无影响,故C错误;
D.滴定管在盛放酸或者碱溶液时必须润洗,否则会将待装液稀释,如:酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,导致标准液浓度减小,滴定时消耗的标准液体积偏大,测得的NaOH溶液的浓度将偏大,故D正确;
E.配制溶液时,定容时俯视度数,溶液体积偏小,根据c=$\frac{n}{V}$可知浓度偏小,故E错误;
F.中和滴定时,若在最后一次读数时俯视读数,则消耗的标准溶液体积偏大,则测得的NaOH溶液的浓度将偏大,故F正确.
故答案为:ABDF.
点评 本题考查了配制一定物质的量浓度的溶液方法、中和滴定中滴定管的使用、误差分析等知识,题目难度中等,注意掌握配制一定物质的量浓度的溶液方法和中和滴定实验.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
9.下列叙述正确的是( )
| A. | 分子晶体中的每个分子内一定含有共价键 | |
| B. | 金属晶体的熔点和沸点都很高 | |
| C. | 离子晶体中可能含有共价键 | |
| D. | 原子晶体中的相邻原子间只存在非极性共价键 |
10.将下列液体分别与溴水充分混合并振荡,静置后上层液体呈现橙色,下层液体是无色的是( )
| A. | CCl4 | B. | 苯 | C. | 戊烯 | D. | 乙醇 |
7.下列措施肯定能使化学反应速率增大的是( )
①增大反应物的量 ②减小压强 ③升高温度 ④使用正催化剂.
①增大反应物的量 ②减小压强 ③升高温度 ④使用正催化剂.
| A. | ①②③ | B. | ③④ | C. | ②③④ | D. | ①②③④ |
14.已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z的二价阳离子与氖原子具有相同的核外电子排布,W与Y同主族,下列说法正确的是( )
| A. | R的原子半径在五种原子中最大 | |
| B. | Y的氢化物的稳定性比W的强 | |
| C. | X与Y形成的化合物只有一种 | |
| D. | R的最高价氧化物的水化物的酸性比W的弱 |
9.现有部分短周期元素的性质或原子结构如下表:
(1)A的气态氢化物的化学式是H2S,元素B(含8个中子)的一种同位素可测定文物年代,这种同位素的符号是146C.
(2)写出元素F的离子结构示意图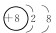 .
.
(3)写出G元素最高价氧化物对应的水化物的化学式是Al(OH)3.
(4)元素D与元素A相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与氢氧化钠溶液反应
(5)A、B、C、D四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种酸的是H2CO3,理由是碳酸属于弱酸,其它三种酸均为强酸.
(6)C、E、F、G四种元素的单质中化学性质明显不同于其他三种单质的是Al,理由Al具有金属性或是金属.
(7)F的阴离子和G的阳离子的半径大小比较:F->Al3+(用离子符号表示)
(8)A、D的简单离子的还原性强弱:S2->Cl-(用离子符号表示)
| 元素编号 | 元素性质或原子结构 |
| A | 室温下其单质呈粉末状黄色固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 最外层电子数比次外层电子数多3个 |
| D | 元素最高正价是+7价 |
| E | 主族元素中得电子能力最强 |
| F | 空气的主要成分之一,其某种同素异形体是保护地球地表环境的重要屏障 |
| G | 第3周期元素的简单离子中半径最小 |
(2)写出元素F的离子结构示意图
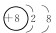 .
.(3)写出G元素最高价氧化物对应的水化物的化学式是Al(OH)3.
(4)元素D与元素A相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与氢氧化钠溶液反应
(5)A、B、C、D四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种酸的是H2CO3,理由是碳酸属于弱酸,其它三种酸均为强酸.
(6)C、E、F、G四种元素的单质中化学性质明显不同于其他三种单质的是Al,理由Al具有金属性或是金属.
(7)F的阴离子和G的阳离子的半径大小比较:F->Al3+(用离子符号表示)
(8)A、D的简单离子的还原性强弱:S2->Cl-(用离子符号表示)
10.常温下,若将pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
| A. | 生成了一种强酸弱碱盐 | B. | 弱酸溶液和强碱溶液反应 | ||
| C. | 强酸溶液和弱碱溶液反应 | D. | 一元强酸溶液和一元强碱溶液 |