题目内容
【题目】高铁酸钾(K2Fe04)是一种理想的绿色高效水处理剂。某学习小组用如图所示装置(夹持仪器已略去)制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备K2Fe04。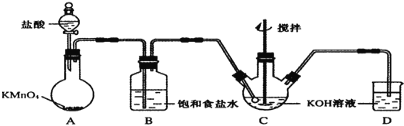
查阅资料知K2FeO4的部分性质如下:①可溶于水、微溶于浓KOH溶液;
②在0-5℃、强碱性溶液中比较稳定;
③在Fe3+和Fe(OH)3催化作用下发生分解;
④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
请回答下列问题:
(1)仪器C和D中都盛有KOH溶液,其中C中KOH溶液的用途是_____。
(2)Cl2与KOH的浓溶液在较高温度下反应生成KClO3。为保证反应生成KClO,需要将反应温度控制在0-5℃,在不改变KOH溶液浓度的前提下,实验中可以采取的措施是_____。
(3)在搅拌条件下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中即可制取K2Fe04,写出该反应的化学方程式_____;该操作不能将KClO饱和溶液滴加到Fe(NO3)3饱和溶液中,其原因是_____。
(4)制得的粗产品中含有Fe(OH)3、KCl等杂质。一种提纯方案为:将一定量的K2Fe04粗产品溶于冷的3mol/LKOH溶液中,用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,再用砂芯漏斗过滤,晶体用适量乙醇洗涤2-3次后,在真空干燥箱中干燥。
①第一次和第二次过滤得到的固体分别对应的是(填化学式)_____、_____。
②晶体用乙醇洗涤的原因是_____。
【答案】和氯气反应制备KClO装置C加冰水浴冷却Fe(NO3)3+3KClO+10KOH=2K2FeO4+3KCl+6KNO3+5H2O生成的K2FeO4在Fe3+催化作用下会发生分解Fe(OH)3K2FeO4乙醇挥发时带走水分,防止K2FeO4与水发生反应
【解析】
根据实验装置图可知,A装置中用高锰酸钾与盐酸反应制得氯气,氯气中有挥发出的来的氯化氢,所以B装置中饱和食盐水是除去氯气中的氯化氢,装置C中用氯气与氢氧化钾溶液应制得次氯酸钾,反应的尾气氯气用氢氧化钾吸收。
(1)装置C中用氯气与氢氧化钾溶液应制得次氯酸钾,作氧化剂;
(2)Cl2和KOH在较高温度下反应生成KClO3,制取KClO温度反应在0℃~5℃,装置C应放在冰水浴中,应降低通入氯气的速率;
(3)在KOH溶液中,Fe(NO3)3与KClO应生成K2FeO4、KCl和KNO3;生成的K2FeO4在Fe3+催化作用下会发生分解。
(4)①用砂芯漏斗过滤,除去氢氧化铁,由于K2FeO4可溶于水、微溶于浓KOH溶液,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,析出K2FeO4晶体,再进行过滤;②乙醇挥发时带走水分,防止K2FeO4与水发生反应.
(1)装置C中用氯气与氢氧化钾溶液应制得次氯酸钾,作氧化剂;
(2)Cl2和KOH在较高温度下反应生成KClO3,制取KClO温度反应在0℃~5℃,装置C应放在冰水浴中,缓慢滴加盐酸,减慢生成氯气的速率;
(3)将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中即可制取K2FeO4,则在KOH溶液中,Fe(NO3)3与KClO应生成K2FeO4、KCl和KNO3,反应的方程式为:2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O;该操作不能将KClO饱和溶液滴加到Fe(NO3)3饱和溶液中,其原因是生成的K2FeO4在Fe3+催化作用下会发生分解;
(4)①因为Fe(OH)3不溶于水,所以第一次用砂芯漏斗过滤,除去Fe(OH)3,则得到的固体为Fe(OH)3,由于K2FeO4可溶于水、微溶于浓KOH溶液,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,析出K2FeO4晶体,再进行过滤,则第二次用砂芯漏斗过滤,得到K2FeO4晶体;②乙醇挥发时带走水分,防止K2FeO4与水发生反应.

【题目】Ⅰ.氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分化学平衡常数K的值。
反应 | 大气固氮N2(g)+O2(g)2NO(g) | 工业固氮N2(g)+3H2(g)2NH3(g) | |||
温度/℃ | 27 | 2 000 | 25 | 400 | 450 |
平衡常数K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因:____________________________。
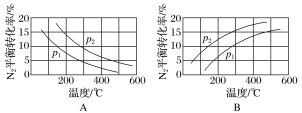
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较p1、p2的大小关系:________。
Ⅱ.目前工业合成氨的原理是N2(g)+3H2(g)2NH3(g)。
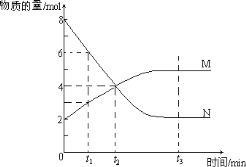
(3)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol。
①达平衡时,H2的转化率α1=________。
②已知平衡时,容器压强为8 MPa,则平衡常Kp=________(用平衡分压代替浓度计算,分压=总压×物质的量分数)。