题目内容
【题目】某同学想通过比较元素的最高价氧化物对应的水化物的酸性强弱来证明硫和碳的得电子能力强弱,设计了如图所示装置进行探究,可供选择的试剂有:稀盐酸、稀硫酸、碳酸钙、碳酸钠、澄清石灰水,请回答下列问题:
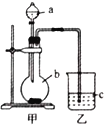
(1)仪器a中应盛放的药品是_____,仪器b中应盛放的药品是____,装置乙中应盛放的药品是______.
(2)装置甲中发生反应的离子方程式为:______;在装置乙中观察到的现象是:_________.
(3)该实验能证明硫与碳的得电子能力的强弱的理论依据是:________.
【答案】稀硫酸 碳酸钠 澄清石灰水 CO32﹣+2H+═CO2↑+H2O 澄清石灰水变浑浊 硫酸的酸性强于碳酸,所以硫元素的非金属性强于碳元素,硫得电子的能力强于碳
【解析】
比较非金属性的强弱,可根据最高价氧化物的水化物的酸性强弱比较,本题可用稀硫酸与碳酸钠反应验证,C中为澄清石灰水,如变浑浊,则说明生成二氧化碳,可证明硫与碳的得电子能力的强弱。
(1)比较非金属性的强弱时用的是最高价氧化物的水化物,因此在分液漏斗中盛放的是稀硫酸,在圆底烧瓶中盛放的是碳酸盐,碳酸钙与稀硫酸反应生成的硫酸钙是一种微溶物,会附着在碳酸钙的表面,将阻止反应的进行,所以选取的碳酸钠为反应物,产生二氧化碳气体用澄清石灰水来检验,故答案为:稀硫酸;碳酸钠;澄清石灰水;
(2)只要证明圆底烧瓶中有二氧化碳生成,就能说明硫酸的酸性比碳酸的酸性强,即说明硫的非金属性比碳强,因此要用澄清石灰水检验二氧化碳的生成,乙中现象是澄清石灰水变浑浊,所以c中试剂是澄清石灰水,甲中发生的反应为CO32-+2H+═CO2↑+H2O,故答案:CO32-+2H+═CO2↑+H2O;澄清石灰水变浑浊;
(3)硫酸酸性强于碳酸,反应生成二氧化碳,二氧化碳与澄清石灰水反应生成碳酸钙,所以产生的现象为:澄清石灰水变浑浊;故答案为:硫酸的酸性强于碳酸,所以硫元素的非金属性强于碳元素,硫的电子的能力强于碳。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案