题目内容
【题目】元素铬![]() 在溶液中主要以
在溶液中主要以![]() 蓝紫色
蓝紫色![]() 、
、![]() 绿色
绿色![]() 、
、![]() 橙红色
橙红色![]() 、
、![]() 黄色
黄色![]() 等形式存在,
等形式存在,![]() 为难溶于水的灰蓝色固体,回答下列问题:
为难溶于水的灰蓝色固体,回答下列问题:
(1)![]() 与
与![]() 的化学性质相似,在
的化学性质相似,在![]() 溶液中逐滴加入NaOH溶液直至过量,可察到的现象是 ______________________________________________ .
溶液中逐滴加入NaOH溶液直至过量,可察到的现象是 ______________________________________________ .
(2)![]() 和
和![]() 在溶液中可相互转化
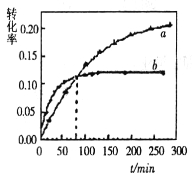
在溶液中可相互转化![]() 室温下,初始浓度为
室温下,初始浓度为![]() 的
的![]() 溶液中
溶液中![]() 随
随![]() 的变化如图所示.
的变化如图所示.

![]() 用离子方程式表示
用离子方程式表示![]() 溶液中的转化反应______________________________ .
溶液中的转化反应______________________________ .
![]() 由图可知,溶液酸性增大,
由图可知,溶液酸性增大,![]() 的平衡转化率__________________
的平衡转化率__________________ ![]() 填“增大“减 小”或“不变”
填“增大“减 小”或“不变”![]() 根据A点数据,计算出该转化反应的平衡常数为 _______________ .
根据A点数据,计算出该转化反应的平衡常数为 _______________ .
![]() 升高温度,溶液中
升高温度,溶液中![]() 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的![]() ______
______ ![]() 填“大于”“小于”或“等于”
填“大于”“小于”或“等于”![]() .
.
(3)在化学分析中采用![]() 为指示剂,以
为指示剂,以![]() 标准溶液滴定溶液中的
标准溶液滴定溶液中的![]() ,利用
,利用![]() 与
与![]() 生成砖红色沉淀,指示到达滴定终点
生成砖红色沉淀,指示到达滴定终点![]() 当溶液中
当溶液中![]() 恰好完全沉淀
恰好完全沉淀![]() 浓度等于
浓度等于![]() 时,溶液中
时,溶液中![]() 为 ______
为 ______ ![]() ,此时溶液中
,此时溶液中![]() 等于 ______
等于 ______ ![]() 已知
已知![]() 、AgCl的
、AgCl的![]() 分别为
分别为![]() 和
和![]()
(4)![]() 价铬的化合物毒性较大,常用
价铬的化合物毒性较大,常用![]() 将废液中的
将废液中的![]() 还原成
还原成![]() ,反应的离子方程式为 _________________________________________________ .
,反应的离子方程式为 _________________________________________________ .
【答案】 蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液 ![]() 增大
增大 ![]() 小于
小于 ![]()
![]() 5
5![]()
【解析】![]() 与
与![]() 的化学性质相似,则
的化学性质相似,则![]() 具有两性。由图可知,
具有两性。由图可知,![]() 和
和![]() 在溶液中相互转化的离子方程式为
在溶液中相互转化的离子方程式为![]() 。溶液酸性增大,平衡向正反应方向移动,则
。溶液酸性增大,平衡向正反应方向移动,则![]() 的平衡转化率增大
的平衡转化率增大![]() A点坐标为(1.0,0.25),此时c(
A点坐标为(1.0,0.25),此时c(![]() )=0.5
)=0.5![]() ,则该转化反应的平衡常数为
,则该转化反应的平衡常数为![]() .升高温度,溶液中
.升高温度,溶液中![]() 的平衡转化率减小,说明该平衡向逆反应方向移动,则该反应为放热反应,
的平衡转化率减小,说明该平衡向逆反应方向移动,则该反应为放热反应,![]() 小于
小于![]() .
.
(1)![]() 与
与![]() 的化学性质相似,则
的化学性质相似,则![]() 具有两性,故在
具有两性,故在![]() 溶液中逐滴加入NaOH溶液直至过量,先生成沉淀
溶液中逐滴加入NaOH溶液直至过量,先生成沉淀![]() ,后沉淀又逐渐溶解,可察到的现象是:蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液.
,后沉淀又逐渐溶解,可察到的现象是:蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液.
(2)![]() 由图可知,
由图可知,![]() 和
和![]() 在溶液中相互转化的离子方程式为
在溶液中相互转化的离子方程式为![]() .
.
![]() 由图可知,溶液酸性增大,平衡向正反应方向移动,则
由图可知,溶液酸性增大,平衡向正反应方向移动,则![]() 的平衡转化率增大
的平衡转化率增大![]() A点坐标为(1.0,0.25),此时c(
A点坐标为(1.0,0.25),此时c(![]() )=0.5
)=0.5![]() ,则该转化反应的平衡常数为
,则该转化反应的平衡常数为![]() .
.
![]() 升高温度,溶液中
升高温度,溶液中![]() 的平衡转化率减小,说明该平衡向逆反应方向移动,则该反应为放热反应,
的平衡转化率减小,说明该平衡向逆反应方向移动,则该反应为放热反应,![]() 小于
小于![]() .
.
(3)在化学分析中采用![]() 为指示剂,以
为指示剂,以![]() 标准溶液滴定溶液中的
标准溶液滴定溶液中的![]() ,利用
,利用![]() 与
与![]() 生成砖红色沉淀,指示到达滴定终点
生成砖红色沉淀,指示到达滴定终点![]() 当溶液中
当溶液中![]() 恰好完全沉淀
恰好完全沉淀![]() 浓度等于
浓度等于![]() 时,溶液中
时,溶液中![]() 为
为![]()
![]() ,此时溶液中
,此时溶液中![]() 等于
等于![]()
![]()
![]()
(4)![]() 价铬的化合物毒性较大,常用
价铬的化合物毒性较大,常用![]() 将废液中的
将废液中的![]() 还原成
还原成![]() ,反应的离子方程式为
,反应的离子方程式为 ![]()

【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:![]() 已知
已知![]()
容器 | 甲 | 乙 | 丙 |
反应物的投入量 |
|
|
|
|
|
|
|
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
体系的压强 |
|
|
|
反应物的转化率 |
|
|
|
下列说法正确的是![]()
![]()
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()