题目内容
17. 已知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小是主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+1价阳离子的K、L、M能层为全充满结构.
已知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小是主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+1价阳离子的K、L、M能层为全充满结构.回答下列问题:
(1)A、B、C、D几种元素中第一电离能最大的是N(填元素符号);D元素的原子核外有8种不同运动状态的电子;E原子M能层中具有的轨道数为9.
(2)F有两种常见的离子,画出低价态离子价电子排布图
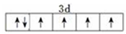 ;在这两种离子之间Fe3+更稳定(填化学式);从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.
;在这两种离子之间Fe3+更稳定(填化学式);从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.(3)由A、B、C、D四种元素形成的某种离子化合物,其原子个数比为4:1:2:1,科学家第一次合成有机物利用的便是这种离子化合物,请根据等电子体原理写出该离子化合物的电子式:
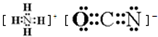 .
.(4)写出G在元素周期表中的位置第四周期第Ⅷ族;G能形成两种互为同分异构体的配合物晶体[G(NH3)6]E3和[G(NH3)5E]E2•NH3,请设计实验方案将这两种配合物区别开来.实验方案:称取相同质量的两种晶体分别配成溶液,向两种溶液中分别滴加足量用硝酸酸化的硝酸银溶液,充分反应后,过滤、洗涤、干燥后称量,所得AgCl固体质量大的,原晶体为[Co(NH3)6]Cl3,所得AgCl固体质量小的,原晶体为[Co(NH3)5Cl]Cl2•NH3.
(5)在图中标出H晶胞中H原子的位置.该晶胞中H原子直径为apm,H的相对原子质量为M,阿伏伽德罗常数为NA,求该晶胞密度表达式$\frac{\sqrt{2}M×1{0}^{30}}{{N}_{A}{a}^{3}}$g/cm3(用a、M、NA表示).
分析 A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小是主族元素,则A为氢;B有三种不同的能级且每种能级上所含电子数相同,核外电子排布为1s22s22p2,故B为碳;C的单质性质稳定且一种氢化物极易溶于水,则C为氮;D能形成两种互为同素异形体的气态单质,则D为氧;F的基态原子中有4个未成对电子,只能处于第四周期,外围电子排布为3d6s2,故F为Fe;A、D、E的核内质子数之和与F的核内质子数相同,则E原子质子数为26-1-8=17,故E为Cl;G比F原子多一个核内质子,则G为Co;上述H元素的+1价阳离子的K、L、M能层为全充满结构,H原子核外电子数为2+8+18+1=19,故H为Cu,据此解答.
解答 解:A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小是主族元素,则A为氢;B有三种不同的能级且每种能级上所含电子数相同,核外电子排布为1s22s22p2,故B为碳;C的单质性质稳定且一种氢化物极易溶于水,则C为氮;D能形成两种互为同素异形体的气态单质,则D为氧;F的基态原子中有4个未成对电子,只能处于第四周期,外围电子排布为3d6s2,故F为Fe;A、D、E的核内质子数之和与F的核内质子数相同,则E原子质子数为26-1-8=17,故E为Cl;G比F原子多一个核内质子,则G为Co;上述H元素的+1价阳离子的K、L、M能层为全充满结构,H原子核外电子数为2+8+18+1=19,故H为Cu.
(1)同周期自左而右第一电离能呈增大趋势,N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,一般非金属性越强,第一电离能越大,故第一电离能H<C<O<N;
D为O元素,元素的原子核外有8种不同运动状态的电子;
E为Cl元素,原子M能层有3s、3p、3d能级,分别有1、3、5个原子轨道,故M能层中具有的轨道数为9,
故答案为:N;8;9;
(2)F有两种常见的离子,低价态离子为Fe2+,价电子排布图为 ;在这两种离子中,Fe3+离子的3d轨道为半满稳定状态,比Fe2+稳定,
;在这两种离子中,Fe3+离子的3d轨道为半满稳定状态,比Fe2+稳定,
故答案为: ;Fe3+;Fe3+离子的3d轨道为半满稳定状态;
;Fe3+;Fe3+离子的3d轨道为半满稳定状态;
(3)由H、C、N、O四种元素形成的某种离子化合物,其原子个数比为4:1:2:1,该化合物为NH4CNO,
CNO-离子与CO2等电子体,二者结构相似,则NH4CNO的电子式为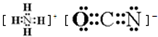 ,
,
故答案为: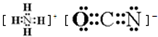 ;
;
(4)G为Co元素,在元素周期表中的位置:第四周期第Ⅷ族;G能形成两种互为同分异构体的配合物晶体[Co(NH3)6]Cl3和[Co(NH3)5Cl]Cl2•NH3,内界氯离子不能与硝酸银反应,外界氯离子可以与硝酸银反应,将这两种配合物区别开来的实验方案:称取相同质量的两种晶体分别配成溶液,向两种溶液中分别滴加足量用硝酸酸化的硝酸银溶液,充分反应后,过滤、洗涤、干燥后称量,所得AgCl固体质量大的,原晶体为[Co(NH3)6]Cl3,所得AgCl固体质量小的,原晶体为[Co(NH3)5Cl]Cl2•NH3,
故答案为:第四周期第Ⅷ族;称取相同质量的两种晶体分别配成溶液,向两种溶液中分别滴加足量用硝酸酸化的硝酸银溶液,充分反应后,过滤、洗涤、干燥后称量,所得AgCl固体质量大的,原晶体为[Co(NH3)6]Cl3,所得AgCl固体质量小的,原晶体为[Co(NH3)5Cl]Cl2•NH3;
(5)H为Cu,晶体属于面心立方密堆积,晶胞中Cu原子的位置为: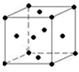 ,
,
该晶胞中H原子直径为apm,则晶胞棱长=a×10-10cm×2×$\frac{\sqrt{2}}{2}$=$\sqrt{2}$a×10-10cm,则晶胞体积为($\sqrt{2}$a×10-10cm)3,晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故晶胞质量为$\frac{4M}{{N}_{A}}$g,则晶胞的密度为$\frac{4M}{{N}_{A}}$g÷($\sqrt{2}$a×10-10cm)3=$\frac{\sqrt{2}M×1{0}^{30}}{{N}_{A}{a}^{3}}$g/cm3,
故答案为: ;$\frac{\sqrt{2}M×1{0}^{30}}{{N}_{A}{a}^{3}}$.
;$\frac{\sqrt{2}M×1{0}^{30}}{{N}_{A}{a}^{3}}$.
点评 本题是对物质结构的考查,涉及电离能、核外电子排布、等电子原理、配合物、晶胞计算等,是对学生综合能力的考查,(4)中注意配合物内界离子与外界离子性质的不同,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 最终三支试管的颜色各不相同 | |
| B. | A试管中Fe(OH)3含量最高 | |
| C. | 直接加热蒸发Fe2(SO4)3溶液可得到Fe2(SO4)3晶体 | |
| D. | B试管中Fe2(SO4)3不能发生水解 |
| A. |  钾的燃烧实验 | B. |  用强碱滴定强酸 | ||
| C. |  铁与H2O(g)反应 | D. |  探究温度对平衡移动的影响 |
 科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的物质,下列说法正确的是( )
科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的物质,下列说法正确的是( )| A. | 分子中不含有非极性键 | B. | 1mol该分子中含8mol二氧化氮 | ||
| C. | 该物质既有氧化性又有还原性 | D. | 该物质爆炸产物是NO2、C02、H20 |
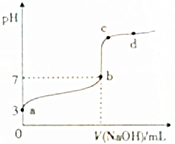 常温下,向20mL0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
常温下,向20mL0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a点表示的溶液中:c(H+)>c(CH3COO-)>c(OH-) | |
| B. | b点时,V(NaOH)=20mL | |
| C. | c点表示的溶液中:c(H+)+c(Na+)=c(OH-)+c(CH3COO-) | |
| D. | d点表示的溶液中:c(Na+)>c(CH3COO-) |

| A. | 碘元素的质子数为53 | |
| B. | 碘原子的质量数为126.9 | |
| C. | 碘原子核外有5种不同能量的电子 | |
| D. | 碘原子最外层有7种不同运动状态的电子 |
| A. | 测定某二元弱酸钠盐溶液的pH,可能小于7 | |
| B. | 稀释0.1mol/LCH3COOH(aq),$\frac{c(O{H}^{-})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$可能变大也可能变小 | |
| C. | 在20.00ml浓度均为0.100 mol/L的HCl与CH3COOH混合溶液中滴加0.200mol/LNaOH溶液至pH=7,NaOH溶液体积一定小于20.00ml | |
| D. | pH=8的碱性溶液中一定没有CH3COOH分子 |
| A. | 丙烷与甲烷互为同系物 | |
| B. | 通常条件下,丙烷性质稳定,不与酸、碱和氧化剂发生反应 | |
| C. | 丙烷燃烧是吸热反应 | |
| D. | 火炬燃料用丙烷比用煤油更环保 |
 .
.