题目内容
14.在A、B、C三支试管中分别加入等体积0.1 mol/L Fe2(SO4)3溶液.将A试管在酒精灯火焰上加热到沸腾,向B试管中加3滴6 mol/L H2SO4.下列说法不正确的是( )| A. | 最终三支试管的颜色各不相同 | |
| B. | A试管中Fe(OH)3含量最高 | |
| C. | 直接加热蒸发Fe2(SO4)3溶液可得到Fe2(SO4)3晶体 | |
| D. | B试管中Fe2(SO4)3不能发生水解 |
分析 硫酸铁溶液中铁离子水解,溶液呈酸性,水解过程为吸热反应,反应的离子方程式为Fe3++3H2O?Fe(OH)3+3H+,A试管加热促进水解正向进行生成氢氧化铁胶体,颜色变深,B中加入3滴6 mol/L H2SO4,氢离子浓度增加,水解平衡逆向进行铁离子浓度增大.
解答 解:硫酸铁溶液中铁离子水解,溶液呈酸性,水解过程为吸热反应,反应的离子方程式为Fe3++3H2O?Fe(OH)3+3H+,A试管加热促进水解正向进行生成氢氧化铁胶体,颜色变深,B中加入3滴6 mol/L H2SO4,氢离子浓度增加,水解平衡逆向进行铁离子浓度增大;
A、上述分析可知,A中颜色加深,B中溶液颜色略微变深,最终三支试管的颜色各不相同,故A正确;
B、平衡移动方向分析可知,A中氢氧化铁含量最高,故B正确;
C、直接加热蒸发Fe2(SO4)3溶液,水解生成氢氧化铁和硫酸,硫酸是难挥发性酸,加热蒸发过程中是蒸发水,可得到Fe2(SO4)3晶体,故C错误;
D、B中是一致了水解平衡,不能抵消铁离子的水解,故D正确;
故选C.
点评 本题考查了盐类水解的分析应用,注意影响平衡的因素分析判断,微粒浓度变化和溶液颜色变化的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
2.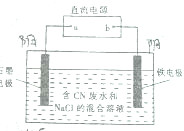 工业上,在强碱性条件下用电解法除去废水中的CN-,装制如图所示,依次发生的反应有:
工业上,在强碱性条件下用电解法除去废水中的CN-,装制如图所示,依次发生的反应有:
①CN--2e-+2OH-═CNO-+H2O
②2Cl--2e-═Cl2↑
③3Cl2+2CNO-+8OH-═N2+6Cl-+2CO32-+4H2O
下列说法不正确的是( )
 工业上,在强碱性条件下用电解法除去废水中的CN-,装制如图所示,依次发生的反应有:
工业上,在强碱性条件下用电解法除去废水中的CN-,装制如图所示,依次发生的反应有:①CN--2e-+2OH-═CNO-+H2O
②2Cl--2e-═Cl2↑
③3Cl2+2CNO-+8OH-═N2+6Cl-+2CO32-+4H2O
下列说法不正确的是( )
| A. | a是电源的正极 | |
| B. | 铁电极上发生的电极反应式为2H++2e-═H2↑ | |
| C. | 为了使电解池连续工作,需要不断补充NaOH | |
| D. | 除去1mol CN-,电解过程中共产生标准状况下11.2L气体 |
9.短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应水化物的酸性比W的强 | |
| D. | Y的气态简单氢化物的热稳定性比W的强 |
19.对以下描述的解释或结论中,正确的是( )
| 选项 | 描述 | 解释或结论 |
| A | 向某溶液中加入BaCl2溶液生成白色沉淀,继续加稀硝酸沉淀不消失 | 溶液中含SO42- |
| B | Cl2+H2O=HClO+HCl | Cl2仅为还原剂,HCl为氧化产物 |
| C | PH=1的溶液中Fe2+、Al3+、SO42-、MnO4-不能大量共存 | 5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
| D | SO2使酸性高锰酸钾溶液和品红试液褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
 ;
;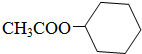 ;
; ②H20
②H20 ③O=C=O
③O=C=O ④CCl4
④CCl4 ⑤Fe2+Fe2+⑥N2
⑤Fe2+Fe2+⑥N2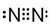
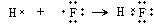 .
. 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力. 、④HCHO等,其中分子属于平面结构的有①②③④(填物质序号),预测HCHO分子的立体结构为平面三角形.
、④HCHO等,其中分子属于平面结构的有①②③④(填物质序号),预测HCHO分子的立体结构为平面三角形.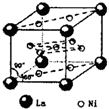 ,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上.该晶体的化学式为Ni5La或LaNi5.
,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上.该晶体的化学式为Ni5La或LaNi5. 已知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小是主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+1价阳离子的K、L、M能层为全充满结构.
已知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小是主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+1价阳离子的K、L、M能层为全充满结构.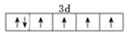 ;在这两种离子之间Fe3+更稳定(填化学式);从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.
;在这两种离子之间Fe3+更稳定(填化学式);从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.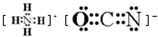 .
.