题目内容
3.已知不同金属离子在溶液中完全沉淀时,溶液的pH不同.| 溶液中被沉淀的离子 | Fe3+ | Cu2+ |
| 完全生成氢氧化物沉淀时溶液的pH | ≥3.7 | ≥4.4 |
分析 根据表可知,Fe3+完全沉淀时,Cu2+没有沉淀,FeCl3易水解生成氢氧化铁,除杂不能引入新的杂质,据此解题.
解答 解:根据表可知,Fe3+完全沉淀时,Cu2+没有沉淀,FeCl3易水解生成氢氧化铁,加入氧化铜或氢氧化铜或碳酸铜,调节溶液的pH,促进铁离子的水解,且不引入新的杂质,答:FeCl3易水解生成氢氧化铁,加CuO调节pH除去旧杂质不能引入新的杂质.
点评 本题考查物质的分离、提纯和除杂等问题,题目难度不大,根据除杂是不能引入新的杂质、不能影响被提纯的物质的性质和量,并且操作简单可行,除杂时要结合物质的物理性质和化学性质进行分离.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
13. “天宫一号”飞行器白天靠太阳能帆板产生电流向镍氢电池充电,夜间镍氢电池向飞行器供电.镍氢电池结构示意图如图.若电池总反应为:2Ni(OH)2 $?_{放电}^{充电}$ 2NiOOH+H2↑,则下列说法正确的是( )
“天宫一号”飞行器白天靠太阳能帆板产生电流向镍氢电池充电,夜间镍氢电池向飞行器供电.镍氢电池结构示意图如图.若电池总反应为:2Ni(OH)2 $?_{放电}^{充电}$ 2NiOOH+H2↑,则下列说法正确的是( )
 “天宫一号”飞行器白天靠太阳能帆板产生电流向镍氢电池充电,夜间镍氢电池向飞行器供电.镍氢电池结构示意图如图.若电池总反应为:2Ni(OH)2 $?_{放电}^{充电}$ 2NiOOH+H2↑,则下列说法正确的是( )
“天宫一号”飞行器白天靠太阳能帆板产生电流向镍氢电池充电,夜间镍氢电池向飞行器供电.镍氢电池结构示意图如图.若电池总反应为:2Ni(OH)2 $?_{放电}^{充电}$ 2NiOOH+H2↑,则下列说法正确的是( )| A. | 充电时a极为阳极 | |
| B. | 放电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| C. | 放电时NiOOH发生氧化反应 | |
| D. | 充电时,K+移向b极;放电时,OH-移向a极 |
14.下列说法正确的是( )
| A. | 22.4LN2中一定含有6.02×1023个氮分子 | |
| B. | 1LH2O中溶解了0.5molNaCl,则该溶液的物质的量浓度为0.5mol/L | |
| C. | 从1L1mol/LC12H22O11溶液中取出10mL,则取出的10mL溶液物质的量的浓度仍为1mol/L | |
| D. | 1LH2SO4溶液中含有98g H2SO4,则该溶液的物质的量浓度为98g/L |
18.已知常温常压下在1L的水中可溶解40L NO2,NO2能与NaOH溶液发生反应:2NaOH+2NO2═NaNO3+Na2NO2 +H2O.以下各种尾气吸收装置中,不适合吸收NO2气体的是( )
| A. | 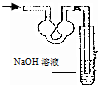 | B. | 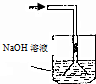 | C. | 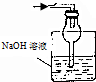 | D. | 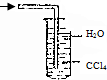 |
1.已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价Cr的强氧化性,其毒性是+3价Cr毒性的100倍.因此,必须对含铬的废水进行处理.目前研究和采用的处理方法主要有:
方法一、还原法:在酸性介质中用FeSO4、NaHSO3等将+6价Cr还原成+3价Cr.具体流程如下:

有关离子完全沉淀的pH如下表.
请回答下列问题:
(1)在②中调节pH的范围至B为最好.(填序号)
A.3~4 B.6~8 C.10~11 D.12~14
(2)若在①使FeSO4适当过量、空气适量,使Fe2+与Fe3+的比例恰当时,可产生具有磁性、组成类似于Fe3O4•xH2O的铁氧体悬浮物,变废为宝.则控制空气适量的目的是使溶液中Fe2+与Fe3+的比例恰当,使铁氧体分离出来较简便的方法是用磁铁吸引.
方法二、电解法:将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3十在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(3)写出此阴极反应的电极方程式2H2O+2e-═H2↑+2OH-.现用上法处理1×104 L含铬(+6价)78mg/L的废水,电解时阳极物质消耗的质量至少为2.52kg.
方法一、还原法:在酸性介质中用FeSO4、NaHSO3等将+6价Cr还原成+3价Cr.具体流程如下:

有关离子完全沉淀的pH如下表.
| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 |
| 完全沉淀的pH | 9.0 | 3.2 | 5.6 |
(1)在②中调节pH的范围至B为最好.(填序号)
A.3~4 B.6~8 C.10~11 D.12~14
(2)若在①使FeSO4适当过量、空气适量,使Fe2+与Fe3+的比例恰当时,可产生具有磁性、组成类似于Fe3O4•xH2O的铁氧体悬浮物,变废为宝.则控制空气适量的目的是使溶液中Fe2+与Fe3+的比例恰当,使铁氧体分离出来较简便的方法是用磁铁吸引.
方法二、电解法:将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3十在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(3)写出此阴极反应的电极方程式2H2O+2e-═H2↑+2OH-.现用上法处理1×104 L含铬(+6价)78mg/L的废水,电解时阳极物质消耗的质量至少为2.52kg.
8.如表所示五种元素中,除M外其余均为短周期元素,Z和W的核外电子数之和是X核外电子数的5倍,下列说法$\underset{不}{•}$$\underset{正}{•}$$\underset{确}{•}$的是( )
| X | Y | |||
| Z | W | |||
| M |
| A. | M与Y可能形成M2Y3和M2Y5化合物 | |
| B. | 原子半径大小关系:Z>X>Y | |
| C. | 不能通过电解熔融Z、W组成的物质制备Z单质 | |
| D. | Y可以形成多种氢化物,其沸点均比X与H形成的化合物高 |
5.X、Y代表两种非金属元素,下列不能说明非金属性X比Y强的是( )
| A. | 氢化物稳定性HmX>HnY | |
| B. | X的含氧酸的酸性比Y的含氧酸的酸性强 | |
| C. | X的单质(X2)能将Y的阴离子(Y2-)氧化,并发生置换反应 | |
| D. | X、Y的单质分别与Fe化合,产物中前者Fe为+3价,后者Fe为+2价 |
6.下列有关实验操作的说法正确的是( )
| A. | 用10mL量筒量取8.10mL稀盐酸;用托盘天平称取25.0g氯化钠 | |
| B. | 可用25mL碱式滴定管量取20.00mL KMnO4溶液 | |
| C. | 用pH试纸测得某溶液的pH为2 | |
| D. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 |