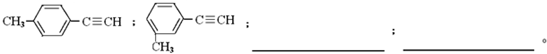题目内容
5.X、Y代表两种非金属元素,下列不能说明非金属性X比Y强的是( )| A. | 氢化物稳定性HmX>HnY | |
| B. | X的含氧酸的酸性比Y的含氧酸的酸性强 | |
| C. | X的单质(X2)能将Y的阴离子(Y2-)氧化,并发生置换反应 | |
| D. | X、Y的单质分别与Fe化合,产物中前者Fe为+3价,后者Fe为+2价 |
分析 元素的非金属性越强,其氢化物的稳定性越强,其单质的氧化性越强,其最高价氧化物的水化物酸性越强,据此分析解答.
解答 解:元素的非金属性越强,其氢化物的稳定性越强,其单质的氧化性越强,其最高价氧化物的水化物酸性越强,
A.氢化物稳定性HmX>HnY,说明非金属性X>Y,故A不选;
B.X的含氧酸的酸性比Y的含氧酸的酸性强,不能说明非金属性X>Y,如酸性H2SO3>HClO,但非金属性Cl>S,故B选;
C.X的单质(X2)能将Y的阴离子(Y2-)氧化,并发生置换反应,说明X单质的氧化性大于Y单质,则非金属性X>Y,故C不选;
D.X、Y的单质分别与Fe化合,产物中前者Fe为+3价,后者Fe为+2价,说明X单质的氧化性大于Y单质,则非金属性X>Y,故D不选;
故选B.
点评 本题考查非金属性强弱判断,为高频考点,非金属性强弱与得电子多少无关,与得电子难易程度有关,易错选项是B.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
3.已知不同金属离子在溶液中完全沉淀时,溶液的pH不同.
据信息分析除去CuCl2中的FeCl3应选用什么试剂,原理是什么?
| 溶液中被沉淀的离子 | Fe3+ | Cu2+ |
| 完全生成氢氧化物沉淀时溶液的pH | ≥3.7 | ≥4.4 |
20.下列反应的离子方程式中,不正确的是( )
| A. | 碳酸氢钠溶液与少量石灰水反应:HCO3+Ca2++OH-=CaCO3↓+H2O | |
| B. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO+H20+CO2=CaCO3↓+2HClO | |
| C. | 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性:Ba2++2OH+2H++SO42-=BaSO4↓+2H2O | |
| D. | 碳酸氢钙溶液中加入盐酸:HCO3+H+=CO2↑+H20 |
10.下列各组混合物中,能用分液漏斗进行分离的是( )
| A. | 醋酸和水 | B. | 碘和苯 | C. | 水和溴苯 | D. | 汽油和煤油 |
17.某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
请你帮助该同学整理并完成实验报告.
(1)实验目的:研究同周期元素性质的递变规律.
(2)实验用品:
试剂:金属钠,镁条、铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液,酚酞试液等.
仪器:①小刀,②胶头滴管,③酒精灯,试管,试管夹,烧杯,镊子,玻璃片,砂纸,滤纸,火柴等.
(3)实验内容:实验②对应的现象:(填相应字母);实验⑥对应的离子反应是Al3++4OH-=AlO2-+2H2O
(4)实验所有实验步骤最终得出的结论是:金属性:Na>Mg>Al 非金属性:Cl>S.
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞试液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③用小刀切割一小块钠擦干煤油后放入滴有酚酞试液的装有冷水的烧杯中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将打磨后的镁投入装有稀盐酸的试管中 | D.反应不十分剧烈,产生无色气体 |
| ⑤将打磨后的铝投入装有稀盐酸的试管中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
(1)实验目的:研究同周期元素性质的递变规律.
(2)实验用品:
试剂:金属钠,镁条、铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液,酚酞试液等.
仪器:①小刀,②胶头滴管,③酒精灯,试管,试管夹,烧杯,镊子,玻璃片,砂纸,滤纸,火柴等.
(3)实验内容:实验②对应的现象:(填相应字母);实验⑥对应的离子反应是Al3++4OH-=AlO2-+2H2O
(4)实验所有实验步骤最终得出的结论是:金属性:Na>Mg>Al 非金属性:Cl>S.
15.1,3,5-己三烯的结构简式:CH2=CH-CH=CH-CH=CH2,对于它与1分子HCl加成后的产物,下列说法正确的是( )
①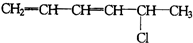
②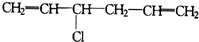
③
④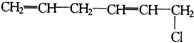
⑤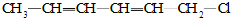
①
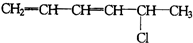
②
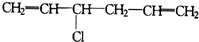
③

④
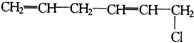
⑤
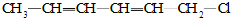
| A. | ③④⑤不可能有 | B. | 只有⑤不可能有 | C. | 全部可能有 | D. | 只有②不可能有 |

 .
.
 同分异构体的结构简式:
同分异构体的结构简式: