题目内容
18.已知常温常压下在1L的水中可溶解40L NO2,NO2能与NaOH溶液发生反应:2NaOH+2NO2═NaNO3+Na2NO2 +H2O.以下各种尾气吸收装置中,不适合吸收NO2气体的是( )| A. | 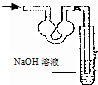 | B. |  | C. |  | D. |  |
分析 由于常温常压下在1 L水中NO2可溶解40 L,即易溶于水,所以在吸收装置中需要防止倒吸,结合装置特征和放倒吸的原理分析判断.
解答 解:由于常温常压下在1 L水中NO2可溶解40 L,即易溶于水,所以在吸收装置中需要防止倒吸,
A、双球干燥管可以防止液体倒吸,故A不符合;
B、和导气管直接插入氢氧化钠溶液相同,B中不能防止倒吸,故B符合;
C、干燥管有较大面积可以防止倒吸,故C不符合;
D、二氧化氮不溶于四氯化碳,上升过程中和上层水反应吸收,可以防止倒吸,故D不符合;
故选B.
点评 本题考查了实验装置防倒吸原理分析和气体性质的理解应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
8.下列各组液体,能用分液的方法将它们分离的是( )
| A. | 水和醋酸 | B. | 溴和水 | C. | 水和植物油 | D. | 猪油和汽油 |
13.25℃时,在强碱性溶液中可以大量共存的离子组是( )
| A. | K+、Cu2+、SO32-、MnO4- | B. | NH4+、Fe2+、NO3-、H+ | ||
| C. | HCO3-、Na+、Mg2+、Cl- | D. | Na+、K+、SO42-、Cl- |
3.已知不同金属离子在溶液中完全沉淀时,溶液的pH不同.
据信息分析除去CuCl2中的FeCl3应选用什么试剂,原理是什么?
| 溶液中被沉淀的离子 | Fe3+ | Cu2+ |
| 完全生成氢氧化物沉淀时溶液的pH | ≥3.7 | ≥4.4 |
20.下列反应的离子方程式中,不正确的是( )
| A. | 碳酸氢钠溶液与少量石灰水反应:HCO3+Ca2++OH-=CaCO3↓+H2O | |
| B. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO+H20+CO2=CaCO3↓+2HClO | |
| C. | 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性:Ba2++2OH+2H++SO42-=BaSO4↓+2H2O | |
| D. | 碳酸氢钙溶液中加入盐酸:HCO3+H+=CO2↑+H20 |

 中的两种基团组成的化合物,与NaOH溶液恰好完全发生反应,反应后所得产物中再通入二氧化碳,也能发生反应的物质可能是苯酚钠、碳酸钠.
中的两种基团组成的化合物,与NaOH溶液恰好完全发生反应,反应后所得产物中再通入二氧化碳,也能发生反应的物质可能是苯酚钠、碳酸钠.
 .
.