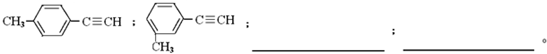题目内容
11.ClO2是一种高效水处理剂,用NaClO2与NCl3反应可以制得ClO2.已知在NCl3分子中成键原子共用电子对偏向N原子,有关反应的化学方程式:NaClO2+NCl+H2O→ClO2↑+NH3↑+NaCl+NaOH(未配平).①该反应中方框内的物质是NaOH(填化学式).
②该反应中被氧化的元素与被还原的元素的物质的量之比为2:1.
分析 ①已知在NCl3分子中成键原子共用电子对偏向N原子,则NCl3分子中N为-3价,Cl为+1价,根据得失电子守恒配平已知反应物和生成物的计量数,再根据原子守恒写出未知的生成物;
②反应物NaClO2中Cl元素的化合价升高,NCl3中Cl的化合价降低,根据方程式计算.
解答 解:①已知在NCl3分子中成键原子共用电子对偏向N原子,则NCl3分子中N为-3价,Cl为+1价,
根据得失电子守恒和原子守恒配平方程式为:6NaClO2+NCl3+3H2O=6ClO2↑+NH3↑+3NaCl+3NaOH;
故答案为:NaOH;
②由方程式6NaClO2+NCl3+3H2O=6ClO2↑+NH3↑+3NaCl+3NaOH可知,反应物NaClO2中Cl元素的化合价升高被氧化,NCl3中Cl的化合价降低被还原,被氧化的元素与被还原的元素的物质的量之比为6:3=2:1;
故答案为:2:1.
点评 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,注意把握氧化还原反应的特征,从元素化合价的角度认识相关概念和物质的性质,结合反应的方程式计算,难度不大.

练习册系列答案
相关题目
1.在120℃时,在反应容积固定的容器内分别进行如下四个反应.若反应前后气体密度和气体总压强分别用d、p表示,则符合关系式d前=d后和p前>p后的反应是( )
| A. | 2H2S+O2═2H2O+2S | B. | 2H2S+3O2═2H2O+2SO2 | ||
| C. | C2H4+3O2═2H2O+2CO2 | D. | C4H8+6O2═4H2O+4CO2 |
19.下列有关说法不正确的是( )
| A. | 氯气通入淀粉碘化钾溶液中,溶液变蓝,氧化性:Cl2>I2 | |
| B. | 久置的氯水最终变为稀盐酸 | |
| C. | NaClO溶液的漂白原理与Na202相同,与SO2不同 | |
| D. | 无色溶液C中加入AgN03溶液,产生白色沉淀,再加入稀盐酸,沉淀不消失,则无色溶液C中一定含有Cl- |
16.已知HNO2 在低温下比较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物,还原产物与溶液PH的关系如表:
下列有关说法错误的是( )
| pH范围 | >7 | <7 |
| 产物 | NO3- | NO、N2O、N2中的一种 |
| A. | 碱性条件下,NaNO2与NaClO反应的离子方程式为NO2-+ClO-═NO3-+Cl- | |
| B. | 向冷的NaNO2溶液中通入CO2可得到HNO2 | |
| C. | 向冷的NaNO2溶液中加入稀硫酸可得到HNO2 | |
| D. | 向冷的NaNO2溶液中加入滴有淀粉的氢碘酸,溶液变蓝色 |
3.已知不同金属离子在溶液中完全沉淀时,溶液的pH不同.
据信息分析除去CuCl2中的FeCl3应选用什么试剂,原理是什么?
| 溶液中被沉淀的离子 | Fe3+ | Cu2+ |
| 完全生成氢氧化物沉淀时溶液的pH | ≥3.7 | ≥4.4 |

 中的两种基团组成的化合物,与NaOH溶液恰好完全发生反应,反应后所得产物中再通入二氧化碳,也能发生反应的物质可能是苯酚钠、碳酸钠.
中的两种基团组成的化合物,与NaOH溶液恰好完全发生反应,反应后所得产物中再通入二氧化碳,也能发生反应的物质可能是苯酚钠、碳酸钠.
 .
.
 同分异构体的结构简式:
同分异构体的结构简式: