题目内容
1.已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价Cr的强氧化性,其毒性是+3价Cr毒性的100倍.因此,必须对含铬的废水进行处理.目前研究和采用的处理方法主要有:方法一、还原法:在酸性介质中用FeSO4、NaHSO3等将+6价Cr还原成+3价Cr.具体流程如下:

有关离子完全沉淀的pH如下表.
| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 |
| 完全沉淀的pH | 9.0 | 3.2 | 5.6 |
(1)在②中调节pH的范围至B为最好.(填序号)
A.3~4 B.6~8 C.10~11 D.12~14
(2)若在①使FeSO4适当过量、空气适量,使Fe2+与Fe3+的比例恰当时,可产生具有磁性、组成类似于Fe3O4•xH2O的铁氧体悬浮物,变废为宝.则控制空气适量的目的是使溶液中Fe2+与Fe3+的比例恰当,使铁氧体分离出来较简便的方法是用磁铁吸引.
方法二、电解法:将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3十在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(3)写出此阴极反应的电极方程式2H2O+2e-═H2↑+2OH-.现用上法处理1×104 L含铬(+6价)78mg/L的废水,电解时阳极物质消耗的质量至少为2.52kg.
分析 (1)Fe2+完全沉淀pH为9.0,Cr3+完全沉淀pH为5.6,要使溶液中Cr3+完全沉淀,且不引入杂质,要调节溶液pH介于二者之间即可;
(2)空气可以将部分Fe2+氧化成Fe3+,铁氧体悬浮物具有磁性,据此判断分离方法;
(3)将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解,阴极上水中的氢离子放电生成氢气,阳极上铁失去电子生成亚铁离子,根据电子得失守恒可计算出铁的质量.
解答 解:(1)Fe2+完全沉淀pH为9.0,Cr3+完全沉淀pH为5.6,要使溶液中Cr3+完全沉淀,且不引入杂质,要调节溶液pH介于二者之间即可,
故选B;
(2)空气可以将部分Fe2+氧化成Fe3+,所以控制空气适量的目的是使溶液中Fe2+与Fe3+的比例恰当,铁氧体悬浮物具有磁性,使铁氧体分离出来较简便的方法是用磁铁吸引,
故答案为:使溶液中Fe2+与Fe3+的比例恰当;用磁铁吸引;
(3)将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解,阴极上水中的氢离子放电生成氢气,阴极反应的电极方程式为2H2O+2e-═H2↑+2OH-,处理1×104 L含铬(+6价)78mg/L的废水,Cr2O72-发生反应,生成的Cr3+,电子转移的物质的量为$\frac{1×1{0}^{4}×78×1{0}^{-3}}{52}×3$mol=45mol,根据电子得失守恒可知,消耗的亚铁离子的物质的量为45mol,所以根据铁元素守恒,用去铁的质量为56×45g=2.52Kg,
故答案为:2H2O+2e-═H2↑+2OH-;2.52.
点评 本题考查了流程分析和电极反应式的书写,难度不大,注意(3)运用元素守恒和电子守恒是解题的关键.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
18.A、B、C为短周期的三种元素,已知A、B处于同周期;A、C的最低价离子分别为A2-和C-;A2-的离子半径大于C-;B2+与C-具相同的电子层结构,以下叙述不正确的是( )
| A. | 原子半径B>A>C | B. | 原子序数A>B>C | ||
| C. | 离子半径A2->B2+>C- | D. | 最外层电子数C>A>B |
19.下列有关说法不正确的是( )
| A. | 氯气通入淀粉碘化钾溶液中,溶液变蓝,氧化性:Cl2>I2 | |
| B. | 久置的氯水最终变为稀盐酸 | |
| C. | NaClO溶液的漂白原理与Na202相同,与SO2不同 | |
| D. | 无色溶液C中加入AgN03溶液,产生白色沉淀,再加入稀盐酸,沉淀不消失,则无色溶液C中一定含有Cl- |
16.已知HNO2 在低温下比较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物,还原产物与溶液PH的关系如表:
下列有关说法错误的是( )
| pH范围 | >7 | <7 |
| 产物 | NO3- | NO、N2O、N2中的一种 |
| A. | 碱性条件下,NaNO2与NaClO反应的离子方程式为NO2-+ClO-═NO3-+Cl- | |
| B. | 向冷的NaNO2溶液中通入CO2可得到HNO2 | |
| C. | 向冷的NaNO2溶液中加入稀硫酸可得到HNO2 | |
| D. | 向冷的NaNO2溶液中加入滴有淀粉的氢碘酸,溶液变蓝色 |
3.已知不同金属离子在溶液中完全沉淀时,溶液的pH不同.
据信息分析除去CuCl2中的FeCl3应选用什么试剂,原理是什么?
| 溶液中被沉淀的离子 | Fe3+ | Cu2+ |
| 完全生成氢氧化物沉淀时溶液的pH | ≥3.7 | ≥4.4 |
6.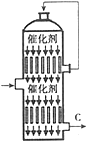 硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.
硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.
(1)以黄铁矿为原料生产SO2时反应的化学方程式为:4FeS2 +11 O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉中进行(填设备名称);
(2)某科研小组测得某硫酸工厂生产工厂中SO2的平衡转化率与外部条件的关系如下表所示,则生产过程中,最适合的生产条件是1个大气压、400℃;
(3)接触室内有一热交换器,其作用是预热原料气,吸收反应放出的热量,若将从C处(如图)出来的气体通入BaCl2溶液中,则主要负电离子方程式为(写总反应式)SO3+Ba2++H2O=BaSO4↓+2H+;
(4)下列做法中,与提高硫酸工业的经济效益无关的是d;
a.适当地对黄铁矿进行粉碎
b.在接触室中使用适当过量的O2
c.利用生产中的余热发电或供暖
d.对废水进行无害化处理后再排放
(5)硫酸工业会产生许多对环境有害的物质,因此无论是工厂厂址的选择还是生产过程中有害成分的处理都要充分考虑环保的要求;
①某市计划建一个硫酸工厂,厂址有A、B、C三个地方可供选择,假设最终该厂建在B地,你认为选择B地建厂的理由是(至少回答两点)B地远离硫酸的消耗中心、B地远离人品稠密的地方;
②将尾气中SO2在一定条件下转化为CaSO4,然后利用焦炭将其转化为CaS(另有一种可燃性气体生成)具有重要的意义,写出CaSO4转化为CaS的化学方程式CaSO4+4C$\frac{\underline{\;高温\;}}{\;}$CaS+4CO;
(6)若用等质量的硫磺,FeS2生产硫酸,假设原料的总利用率均为90%,则二者得到的硫酸质量比为15:8.
 硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.
硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.(1)以黄铁矿为原料生产SO2时反应的化学方程式为:4FeS2 +11 O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉中进行(填设备名称);
(2)某科研小组测得某硫酸工厂生产工厂中SO2的平衡转化率与外部条件的关系如下表所示,则生产过程中,最适合的生产条件是1个大气压、400℃;
| 压强 (Pa) 温度 (℃) | 1.013×105 | 5.065×105 | 10.13×105 | 15.195×105 |
| 400 | 99.61% | 99.72% | 99.84% | 99.88×105 |
| 500 | 96.75% | 97.67% | 98.52% | 98.94% |
| 600 | 85.20% | 88.97% | 92.76% | 94.68% |
(4)下列做法中,与提高硫酸工业的经济效益无关的是d;
a.适当地对黄铁矿进行粉碎
b.在接触室中使用适当过量的O2
c.利用生产中的余热发电或供暖
d.对废水进行无害化处理后再排放
(5)硫酸工业会产生许多对环境有害的物质,因此无论是工厂厂址的选择还是生产过程中有害成分的处理都要充分考虑环保的要求;
①某市计划建一个硫酸工厂,厂址有A、B、C三个地方可供选择,假设最终该厂建在B地,你认为选择B地建厂的理由是(至少回答两点)B地远离硫酸的消耗中心、B地远离人品稠密的地方;
②将尾气中SO2在一定条件下转化为CaSO4,然后利用焦炭将其转化为CaS(另有一种可燃性气体生成)具有重要的意义,写出CaSO4转化为CaS的化学方程式CaSO4+4C$\frac{\underline{\;高温\;}}{\;}$CaS+4CO;
(6)若用等质量的硫磺,FeS2生产硫酸,假设原料的总利用率均为90%,则二者得到的硫酸质量比为15:8.
10.下列各组混合物中,能用分液漏斗进行分离的是( )
| A. | 醋酸和水 | B. | 碘和苯 | C. | 水和溴苯 | D. | 汽油和煤油 |
11.下列实验基本操作(或实验注意事项)中,主要不是从实验安全角度考虑的是( )
| A. | 酒精灯内的酒精用量一般不超过其容积的$\frac{2}{3}$,也不少于其容积的$\frac{1}{4}$ | |
| B. | 用氢气还原氧化铜时,应先通入氢气一会儿,然后再点燃酒精灯加热 | |
| C. | 实验室用高锰酸钾制取氧气结束时,应先将导管从水中取出,然后再停止加热 | |
| D. | 在分液操作中,应将上层液体从分液漏斗的上口倒出 |