题目内容
3.碳及其化合物广泛存在于自然界中,回答下列问题:(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用电子云形象化描述.在基态14C原子中,核外存在2对自旋相反的电子.
(2)碳在形成化合物时,其键型以共价键为主,原因是C有4个价电子且半径较小,难以通过得或失电子达到稳定结构.
(3)CS2分子中,共价键的类型有δ键和π键,C原子的杂化轨道类型是sp,分别写出与CS2具有相同空间构型和键合形式的分子和离子各一个CO2、SCN-.
(4)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253K,沸点为376K,其固体属于分子晶体.
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,每个C原子连接3个六元环,每个六元环占有2个C原子.
②在金刚石晶体中,C原子的配位数是4,12g金刚石中含有2NAC-C.
分析 (1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用电子云形象化描述;根据同一轨道的2两个电子自选方向相反判断;
(2)共价键为原子之间以共用电子对成键,碳的非金属性较弱,但半径较小,反应中难以失去或得到电子;
(3)CS2分子的结构式为S=C=S,含有δ键和π键;结合δ键和孤对电子数判断价层电子对数,以此判断杂化类型;与CS2具有相同空间构型和键合形式的分子或离子为等电子体,应含有3个原子,价电子数为16;
(4)熔点为253K,沸点为376K,具有分子晶体的性质;
(5)①石墨晶体中最小的环为六元环,每个碳原子连接3个C-C化学健,每个C-C化学健被2个碳原子共用;
②在金刚石的晶体结构中每个碳原子与周围的4个碳原子形成四个碳碳单键,每个C原子与其他4个C原子共用4个C-C键,相当于每个C原子占有4×$\frac{1}{2}$=2个C-C键.
解答 解:(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用电子云形象化描述,离核近的区域电子云密度较大,离核远的区域电子云密度较小,C原子核外电子排布为1s22s22p2,轨道式为如图所示: ,则在基态14C原子中,核外存在2对自旋相反的电子,
,则在基态14C原子中,核外存在2对自旋相反的电子,
故答案为:电子云;2;
(2)共价键为原子之间以共用电子对成键,碳原子核外有4个电子,且元素的非金属性较弱,但半径较小,反应中难以失去或得到电子,
故答案为:C有4个价电子且半径较小,难以通过得或失电子达到稳定结构;
(3)CS2分子的结构式为S=C=S,含有δ键和π键,CS2分子中C原子形成2个δ键,孤对电子数为$\frac{4-2×2}{2}$=0,则为sp杂化,
与CS2具有相同空间构型和键合形式的分子或离子为等电子体,应含有3个原子,价电子数为16,常见分子和离子有CO2、SCN-,
故答案为:δ键和π键;sp;CO2、SCN-;
(4)Fe(CO)5熔点为253K,沸点为376K,具有分子晶体的性质,则固体应为分子晶体,故答案为:分子;
(5)①石墨晶体中最小的环为六元环,每个碳原子连接3个C-C化学健,则每个C原子连接 3个六元环,每个六元环占有的C原子数为6×$\frac{1}{3}$=2,故答案为:3;2;
②在金刚石的晶体结构中每个碳原子与周围的4个碳原子形成四个碳碳单键,所以C原子的配位数是4;每个C原子与其他4个C原子共用4个C-C键,相当于每个C原子占有4×$\frac{1}{2}$=2个C-C键,1mol金刚石含2molC-C键,所以12g金刚石中含有2NAC-C,故答案为:4;2NA.
点评 本题主要考查物质结构和性质,侧重考查学生空间想象能力、知识运用能力,涉及晶胞计算、原子结构等知识点,综合性较强,采用均摊法、价层电子对互斥理论等理论分析解答,题目难度中等.

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案①苯不能使KMnO4溶液褪色;
②苯能在一定条件下跟H2加成生成环己烷;
③
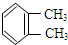 与
与 是同一物质;
是同一物质;④苯不能因化学变化而使溴水褪色.
| A. | ①②③④ | B. | ①③④ | C. | ②④ | D. | ③④ |
| A. | CO2和SiO2 | B. | Na和I2 | C. | 蔗糖和干冰 | D. | 金刚石和石墨 |
| A. | 植物油不能发生水解反应 | |
| B. | 棉花和蚕丝的主要成份都是纤维素 | |
| C. | 淀粉水解的最终产物是葡萄糖 | |
| D. | 蛋白质溶液中加重金属盐发生物理变化 |
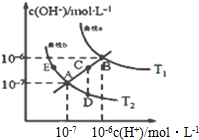 水的电离常数如图两条曲线所示,曲线中的点都符合c(H+)×c(OH-)=常数,下列说法错误的是( )
水的电离常数如图两条曲线所示,曲线中的点都符合c(H+)×c(OH-)=常数,下列说法错误的是( )| A. | 图中温度T1>T2 | |
| B. | 图中五点Kw间的关系:B>C>A=D=E | |
| C. | 曲线a、b可以表示纯水的电离情况 | |
| D. | 若处在B点时,将pH=2的硫酸溶液与pH=11的KOH溶液等体积混合后,溶液显酸性 |
| A. | 1mol 氢 | B. | 1mol O | C. | 1mol 二氧化碳 | D. | 1mol 水 |
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 2.0 | 1.0 | 0.8 | 0.7 | 0.7 | 0.7 |
(1)已知升高温度,NO2的浓度减小,则该反应是放热反应.
(2)图中表示NO2的变化的曲线是b
用O2表示从0~2s内该反应的平均速率v=0.15mol/(L•s)
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c
a.及时分离除NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
 常温下,浓度均为0.1mol•L-1的四种溶液:
常温下,浓度均为0.1mol•L-1的四种溶液: