题目内容
11.(1)用惰性电极电解下列水溶液,请写出电极反应式及总反应离子方程式:AgNO3:阴极:4Ag++4e-=4Ag 阳极:4OH--4e-═O2+2H2O总反应离子方程式:4Ag++2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4H+.
(2)用Cu电极电解下列水溶液,请写出电极反应式及总反应化学方程式:
Na2SO4:阴极:2H++2e-═H2↑ 阳极:Cu-2e-=Cu2+总反应化学方程式:Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$Cu(OH)2+H2↑.
(3)用Cu电极做阴极,石墨电极做阳极电解CuSO4水溶液,请写出电极反应式及总反应离子方程式:
阴极:Cu2++2e-═Cu 阳极:4OH--4e-═O2+2H2O总反应离子方程式:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+.
分析 (1)用惰性电极电解硝酸银溶液时,阳极上氢氧根离子放电,阴极上银离子放电生成银;
(2)用Cu作电极电解硫酸钠溶液时,阴极上氢离子放电生成氢气;阳极上Cu失电子发生氧化反应;
(3)用Cu电极做阴极,石墨电极做阳极电解CuSO4水溶液,阴极上铜离子放电生成铜;阳极上氢氧根离子放电.
解答 解:(1)用惰性电极电解硝酸银溶液时,阳极上氢氧根离子放电,阴极上银离子放电生成银,所以阴极、阳极、电池反应式分别为4Ag++4e-=4Ag,4OH--4e-═O2↑+2H2O,4Ag++2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4H+,
故答案为:4Ag++4e-=4Ag;4OH--4e-═O2↑+2H2O;4Ag++2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4H+;
(2)用Cu作电极电解硫酸钠溶液时,阴极上氢离子放电生成氢气;阳极上Cu失电子发生氧化反应,所以阴极、阳极、电池反应式分别为2H++2e-═H2↑,Cu-2e-=Cu2+,Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$Cu(OH)2+H2↑,故答案为:2H++2e-═H2↑;Cu-2e-=Cu2+;Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$Cu(OH)2+H2↑;
(3)用Cu电极做阴极,石墨电极做阳极电解CuSO4水溶液,阴极上铜离子放电生成铜;阳极上氢氧根离子放电生成氧气,所以阴极、阳极、电池反应式分别为Cu2++2e-═Cu,4OH--4e-═O2↑+2H2O,2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+,
故答案为:Cu2++2e-═Cu;4OH--4e-═O2↑+2H2O;2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+.
点评 本题以原电池和电解池为载体考查电极反应式的书写,为高频考点,明确离子放电书写是解本题关键,结合电解质溶液酸碱性书写电极反应式,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | HF、HCl、HBr 的沸点依次升高 | |
| B. | O、S、Na、K 的原子半径依次增大 | |
| C. | H2S、PH3、HCl、HF 的热稳定性依次增强 | |
| D. | Mg(OH)2、Al(OH)3、KOH、Ca(OH)2 的碱性依次增强 |
| A. | CH4 | B. | C2H2 | C. | C2H4 | D. | C2H6 |
| A. | X和Y可能都是固体 | B. | X和Y至少有一种是气体 | ||
| C. | X和Y可能都是气体 | D. | X和Y一定都是气体 |



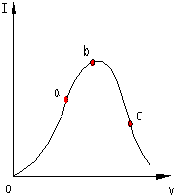 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答: