题目内容
15.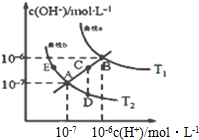 水的电离常数如图两条曲线所示,曲线中的点都符合c(H+)×c(OH-)=常数,下列说法错误的是( )
水的电离常数如图两条曲线所示,曲线中的点都符合c(H+)×c(OH-)=常数,下列说法错误的是( )| A. | 图中温度T1>T2 | |
| B. | 图中五点Kw间的关系:B>C>A=D=E | |
| C. | 曲线a、b可以表示纯水的电离情况 | |
| D. | 若处在B点时,将pH=2的硫酸溶液与pH=11的KOH溶液等体积混合后,溶液显酸性 |
分析 A.水的电离是吸热反应,升高温度促进水电离,则水中c(H+)、c(OH-)及离子积常数增大;
B.水的离子积常数只与温度有关,温度越高,离子积常数越大;
C.只有c(OH-)=c(H+)的点是纯水的电离;
D.B点时,Kw=1×10-12,pH=2的硫酸中c(H+)=0.01mol/L,pH=12的KOH溶液中c(OH-)=1mol/L,等体积混合碱剩余,溶液呈碱性.
解答 解:A.水的电离是吸热反应,升高温度促进水电离,则水中c(H+)、c(OH-)及离子积常数增大,根据图知,T1曲线上离子积常数大于T2,所以T1>T2,温度,故A正确;
B.水的离子积常数只与温度有关,温度越高,离子积常数越大,同一曲线是相同温度,根据图知,温度高低点顺序是B>C>A=D=E,所以离子积常数大小顺序是B>C>A=D=E,故B正确;
C.只有c(OH-)=c(H+)的点是纯水的电离,所以只有A、B点才是纯水的电离,故C错误;
D.B点时,Kw=1×10-12,pH=2的硫酸中c(H+)=0.01mol/L,pH=12的KOH溶液中c(OH-)=1mol/L,等体积混合时碱剩余,溶液呈碱性,故D错误;
故选CD.
点评 本题考查弱电解质的电离,题目难度中等,注意分析图象,把握水的离子积只受温度的影响.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是( )
| 物质 | 试剂 | 分离方法 | |
| ① | 硝酸钾(氯化钠) | 蒸馏水 | 降温结晶 |
| ② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| ③ | 乙醇(水) | 生石灰 | 蒸馏 |
| ④ | 苯(苯酚) | 浓溴水 | 分液 |
| A. | ①② | B. | ①④ | C. | ①③ | D. | ③④ |
10.下列关于有机化合物的说法不正确的是( )
| A. | 油脂的皂化反应属于取代反应 | |
| B. | 丁烷(C4H10)有两种同分异构体 | |
| C. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| D. | 以淀粉为原料可制取乙酸乙酯 |
10.实验室配制1mol•L-1盐酸250mL,下列不需用的仪器是( )
| A. | 250 mL容量瓶 | B. | 托盘天平 | C. | 胶头滴管 | D. | 烧杯 |


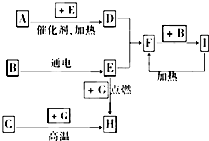 下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去,常温下,G为固体单质,B、I为液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C. H可用作工业上冶炼金属的还原剂.请按要求填空:
下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去,常温下,G为固体单质,B、I为液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C. H可用作工业上冶炼金属的还原剂.请按要求填空: