题目内容
13.氯化亚砜(SOCl2,结构式如图:(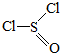 )主要用于制造酰基氯化物,其工业制备原理:
)主要用于制造酰基氯化物,其工业制备原理:SO3+SCl2═SOCl2+SO2,下列有关说法正确的是( )
| A. | SCl2和SOCl2中S的化合价分别为+2、+4价 | |
| B. | 制备反应中,二氧化硫是氧化产物 | |
| C. | 每消耗1mol SCl2,转移1mol电子 | |
| D. | SOCl2分子中既含有离子键又含有共价键 |
分析 A.根据化合物中元素化合价的代数和为零的原则进行分析回答;
B.含元素化合价升高的物质为还原剂,被氧化,对应的产物为氧化产物;
C.根据反应中化合价的变化,每消耗1mol SCl2,转移2mol电子;
D.一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,据此分析解答.
解答 解:A.SCl2和SOCl2中Cl、O的化合价分别是-1价和-2价,根据化合物中元素化合价的代数和为零,则SCl2和SOCl2中S的化合价分别为+2、+4价,故A正确;
B.根据SO3+SCl2═SOCl2+SO2可知,制备反应中三氧化硫中硫元素的化合价从+6价降低到SO2中的+4价,因此二氧化硫是还原产物,故B错误;
C.根据SO3+SCl2═SOCl2+SO2可知,SCl2中硫元素的化合价从+2价升高到SOCl2中的+4价,每消耗1mol SCl2,转移2mol电子,故C错误;
D.SOCl2分子中S原子和Cl原子、S原子和O原子之间只存在共价键,为共价化合物,故D错误;
故选A.
点评 本题考查了氯化亚砜的有关知识,涉及化合价的判断、氧化还原知识、化学键的判断等,熟练应用氧化还原知识,明确物质的构成是解本题关键,题目难度中等.

练习册系列答案
相关题目
3.体积相同pH相等的a杯盐酸和b杯醋酸溶液分别与相同质量的锌反应,若最后锌都完全溶解,则下列判断正确的是( )
| A. | 反应所生成的气体体积:a杯>b杯 | B. | 反应所需要的时间:a杯>b杯 | ||
| C. | 刚开始时反应的速率:b杯>a杯 | D. | 整个反应阶段平均速率:a杯>b杯 |
4.已知NaHSO3溶液和Na2CO3溶液混合后加热煮沸能产生CO2气体.现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,则两溶液中各粒子物质的量浓度的关系一定正确的是(R表示S或C)( )
| A. | c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-) | B. | c(H+)+c(H2RO3)=c(RO32-)+c(OH-) | ||
| C. | c(Na+)>c(HRO3-)>c(H+)>c(OH-)>c(RO32-) | D. | c(HRO3-)>c(H2RO3)>c(OH-)>c(RO32-)>c(H+) |
1.下列图示与对应的叙述相符的是( )
| A. | 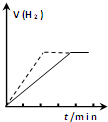 向一定质量的锌与过量的稀硫酸反应的试管中加入少量的CuSO4溶液,如图虚线表示加入CuSO4溶液时氢气体积与时间的关系 | |
| B. | 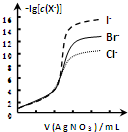 用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图曲线,可确定首先沉淀的是Cl- | |
| C. | 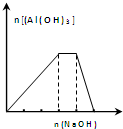 向NH4Al(SO4)2溶液中滴加过量的NaOH溶液,图中曲线表示NaOH的物质的量与Al(OH)3物质的量关系图 | |
| D. | 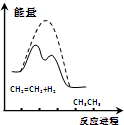 由图可说明乙烯与H2加成反应是放热反应,虚线表示在有催化剂条件下的反应进程 |
5.下列说法不正确的是( )
| A. | 用食醋可除去热水壶内壁的水垢 | |
| B. | 淀粉,油脂 和蛋白质都是高分子化合物 | |
| C. | 服用铬含量超标的药用胶囊会对人对健康造成危害 | |
| D. | 新型复合材料使手机、电脑等电子产品更轻巧、实用和新潮 |
13.COCl2俗称光气,其中心C原子采用sp2杂化成键.下列对该分子结构的分子中错误的是( )
| A. | 分子中所有原子共平面 | B. | 碳氧原子之间含有1个α键和1个π键 | ||
| C. | 分子中既含单键又含双键 | D. | 分子中既含极性键又含非极性键 |